寂寂无闻的广生堂突然成妖。在近一个月的时间中,广生堂股价暴涨超220%。撬动股价持续上涨的诱因,正在于广生堂旗下子公司“广生中霖生物”所研发的抗乙肝病毒药物GST-HG141正式进入临床三期。
凭心而论,临床三期距离最终成药仍有极大的不确定性,为何市场愿意给GST-HG141如此高的预期对价呢?这一切还是与“功能性治愈”乙肝的迫切需求密切相关。作为全球乙肝高负担国家,我国有7500万乙肝病毒携带者,任何临床突破皆可点燃百亿级市场的想象力。
可现实却是,乙肝时至今日也没有能够“治愈”它的特效药。

乙肝为何难以攻克?
时至今日,乙型肝炎依然披着神秘的面纱,发病机制尚未完全阐明。
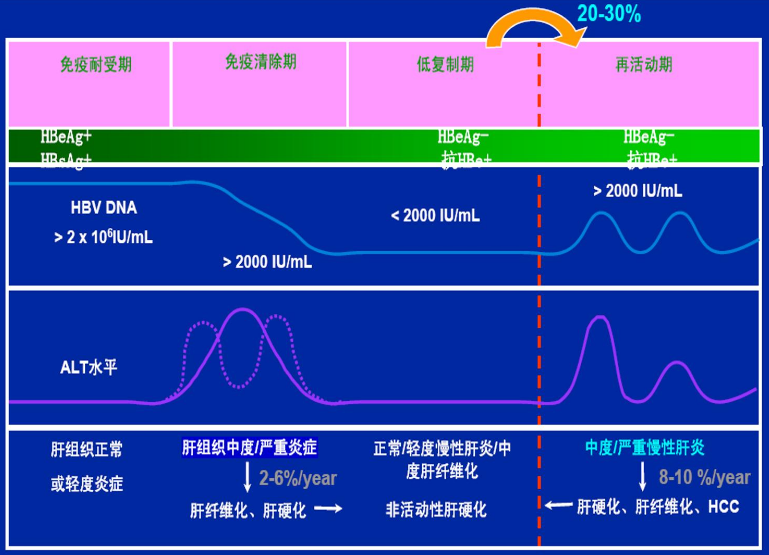
目前主流观点认为,肝细胞损伤并非乙肝病毒(HBV)在肝细胞内复制的直接结果,而是由T细胞毒反应介导。人感染HBV后,会引发细胞免疫与体液免疫应答,同时激发自身免疫反应及免疫调节功能紊乱。这些免疫反应在清除病毒的同时,也导致受感染肝细胞破裂、坏死,即肝病变。
理论上来说,清除乙肝病毒即可实现乙肝治愈,但现实远没有这么简单。乙肝病毒侵入肝细胞后,会形成共价闭合环状DNA(cccDNA)——这种微型染色体结构能在肝细胞核内长期稳定存在,成为无法清除的“病毒库”。现有药物仅能抑制病毒复制,却无法根除cccDNA。即便血液中病毒载量清零,这些潜伏的cccDNA仍可在肝细胞内“休眠”数年甚至数十年,一旦停药便可能死灰复燃,迫使患者终身服药。
其次,病毒与人体免疫系统的博弈加剧了清除难度。
婴幼儿感染HBV时,免疫系统尚未成熟,易形成“免疫耐受”——虽能识别病毒抗原,却主动放弃攻击,任由病毒在肝细胞内繁殖。这种耐受状态可维持数十年,使病毒“和平潜伏”肝脏而无明显炎症。
成年感染者虽能启动免疫反应,但长期病毒暴露会导致特异性T细胞“耗竭”:这些本应清除感染细胞的免疫细胞,表面过量表达PD-1、CTLA-4等抑制性受体,如同被戴“枷锁”,失去杀伤能力。HBV大量分泌的表面抗原(HBsAg)会“迷惑”免疫系统,抑制B细胞产生中和抗体,形成“免疫沉默”循环。
同时,病毒的高变异性构成另一重障碍。HBV的复制依赖逆转录酶,但这种酶缺乏校正功能,导致病毒基因组频繁突变。这些变异不仅能重塑病毒蛋白结构,使药物靶点失活(如核苷类药物耐药突变),更可伪装抗原表位逃避免疫识别。拉米夫定等早期药物就因高达70%的耐药率而逐渐被淘汰。更复杂的是,同一患者体内可能同时存在多种变异株,形成“病毒准种”,如同一个不断进化的“病毒军团”,让单一药物难以全面覆盖。
此外,肝脏微环境的“庇护”进一步强化了病毒的生存优势。慢性乙肝患者肝脏常伴随纤维化,过量胶原蛋白形成的纤维间隔既阻碍药物渗透,又通过低氧、高炎症因子环境稳定cccDNA表达。被病毒激活的枯否细胞分泌大量TGF-β,既促纤维化,又抑制T细胞抗病毒;活化的肝星状细胞释放细胞外基质,包裹感染肝细胞形成物理免疫隔离层,阻碍免疫细胞清除。
这种“病毒-炎症-纤维化”的恶性循环,使乙肝治疗陷入“越治越复杂”的困境,更让乙肝成为“无法根治”的代名词,也不断倒逼乙肝治疗药物在探索中不断破局。

乙肝药物进化史
乙肝治疗历史最早可追溯至二十世纪中叶,其发展脉络与人类对病毒生物学特性的认知深度紧密相关。
在病毒机制尚未明晰的年代,医生面对乙肝几乎束手无策。临床仅有维生素、肝泰乐(葡醛内酯)、肌苷片等护肝药物,它们通过减轻肝脏炎症反应缓解症状,却无法阻止病毒复制。这一阶段实质是“未治疗”状态,药物仅能安抚受损的肝脏,对病毒本身毫无威慑力。
直至1986年干扰素α获批,才开启了抗病毒治疗的新纪元。干扰素通过激活宿主免疫应答实现病毒抑制,却因不足30%的应答率和严重的流感样症状、骨髓抑制等副作用,让多数患者望而却步。1998年首个核苷类药物拉米夫定上市,通过抑制病毒逆转录酶终止DNA链延伸,短期内可将病毒载量降低数万倍,但其1年耐药率高达20%,5年累积耐药率超70%,迫使临床快速迭代出第二代阿德福韦酯。然而,后者抗病毒效力较弱且存在肾毒性,仅能作为补救治疗选择。
2005年恩替卡韦与替诺福韦(TDF)的问世重塑乙肝治疗格局,这两种药物通过强化对病毒逆转录酶的抑制,将HBVDNA阴转率提升至90%以上,五年耐药率低于1.2%。但这类药物仍存在致命缺陷:无法清除肝细胞核内的cccDNA,导致患者需终身服药。即便病毒载量持续检测不到,停药后5年内复发率仍超过50%,而长期用药更伴随肾损伤与骨代谢风险。
在TDF的基础上,吉利德于2016年推出了富马酸丙酚替诺福韦(TAF),通过前药设计精准递送活性成分至肝脏,在保持疗效同时将肾毒性风险压降90%,骨安全性显著提升。然而,即使被外界称为“乙肝神药”,TAF的HBsAg清除率仍徘徊于3%以下,“抑制而非治愈”的局限仍未突破。
面对困境,当前乙肝治疗的理想目标是功能性治愈,即经有限疗程治疗后,血清HBsAg和HBVDNA持续检测不到,HBeAg阴转(伴或不伴HBsAg血清学转换),残留cccDNA可长期存在,但肝脏炎症缓解、肝组织病理学改善,终末期肝病发生率显著降低。
“功能性治愈”的破局方向,主要依赖于联合疗法与新型药物双轨并行。
siRNA联合免疫调节剂通过降解病毒mRNA解除免疫抑制,同时激活耗竭T细胞,将功能性治愈率从不足10%提升至30%,其中低HBsAg(




评论列表