
编者按
过去十余年间,晚期前列腺癌的治疗手段取得了突破性进展。但雄激素剥夺疗法(ADT)仍作为各种联合治疗的基础,发挥着重要的基石作用。在刚刚结束的2024年欧洲肿瘤内科学会(ESMO)年会上,学者们求证ADT在当前治疗中的地位,探索新的联合治疗方案,寻求不良反应的管理措施,以期进一步优化转移性激素敏感性前列腺癌(mHSPC)的管理。本期“益腺学院”特邀中国医科大学附属第一医院张墨教授,深入解读今年ESMO年会中mHSPC相关研究进展,分享其专业见解与实践经验。
专家简介

张墨 教授
中国医科大学附属第一医院
中国医科大学附属第一医院泌尿外科副主任
教授、主任医师、博士生导师
美国加州大学洛杉矶分校UCLA博士后
美国南加州大学USC和City of Hope肿瘤中心高级访问学者
中华医学会泌尿外科分会青年委员
中国抗癌协会泌尿生殖系肿瘤专业委员会委员
辽宁省医学会泌尿外科分会青委副主任委员
沈阳市医师协会泌尿外科分会副会长
国家自然科学基金项目评审专家
主持国家自然科学青年基金、面上项目及省部级项目共7项,以第一作者发表论文40余篇,其中SCI论文17篇(最高影响因子15.3)
辽宁省“百千万”人才
沈阳市青年拔尖人才
沈阳市中青年科技创新人才
沈阳市“五一劳动奖章”获得者
Abstract 1627P 接受ADT±多西他赛治疗的mHSPC长期生存者:GETUG-15研究的长期随访结果[1]
研究背景
在过去十年中,基于多项III期临床研究的结果,强化系统治疗(二联或三联疗法)已成为mHSPC患者的标准治疗。GETUG-15是首个证实ADT联合多西他赛使mHSPC患者获得无进展生存期(PFS)改善的III期临床研究。目前,关于mHSPC患者长期生存的数据仍然较少,且提出了关于持续系统治疗的风险与获益平衡的问题,因此,本研究旨在阐述长期生存mHSPC患者中止使用ADT的情况以及中止后睾酮的变化。
研究方法
作为GETUG-15研究的子研究,共纳入了2004-2008年间参与GETUG-15研究的12个中心的280例患者。收集了在2015年4月最终分析时仍确认生存患者的临床和生物学数据。
研究结果
此项子研究人群的基线特征与GETUG-15研究总体人群相似。截至2015年4月,89例患者(32%)仍生存,构成了长期生存人群,其中位随访时间为13年(范围:6.4-19年)。在这些患者中,44例进展为去势抵抗性前列腺癌(多数发生在2015年4月之前),其余45例患者在最后随访时仍为激素敏感性(详见图1)。由于持续缓解,25例患者(占长期生存人群的28.1%)曾停止ADT治疗超过3个月,ADT的中位持续时间为6.3年(范围:1.6-15.5年)后,治疗中断的中位持续时间为5.6年,其中15例患者未再重启ADT。在停止治疗后,10/25例患者(40%)的血清睾酮水平恢复到0.5 ng/mL以上。在子研究中,ADT+多西他赛显著改善了高瘤负荷患者的总生存(HR=0.689[0.486-0.977],P=0.035)。

图1. 子研究人群的生存和疾病进展趋势
研究结论
这项子研究是首个报告在当前治疗格局下mHSPC患者超过10年长期随访数据的研究。GETUG-15研究中实现长期缓解的患者大多持续使用了ADT。这为当前及未来的临床试验提供了重要的基准。
张墨教授点评
GETUG-15,CHAARTED和STAMPEDE等研究奠定了ADT+多西他赛二联疗法在mHSPC治疗中的地位。其中GETUG-15研究证实:与ADT单药相比,联合多西他赛显著延长了mHSPC患者的PFS(23个月 vs. 13个月,P=0.0052),且有降低高瘤负荷患者死亡风险的趋势(中位OS:39.8个月 vs. 35.1个月,P=0.1)[2]。然而,关于此类患者长期生存的数据却鲜有报道,本次大会摘要1627P首次报告了GETUG-15研究超过10年的长期随访数据。截至最后随访分析日,32%的患者仍然生存。在这些长期生存的患者中,约50%的患者在最后随访时仍对激素治疗敏感。长期随访也证实了ADT联合多西他赛改善了高瘤负荷患者的OS(HR=0.689[0.486-0.977],P=0.035)。
尽管在mHSPC治疗中ADT长久以来处于基石地位,但由于其药理作用带来的心血管、代谢和骨骼等副作用风险,研究者们一直没有放弃在mHSPC中尝试无ADT的方案,但II期LACOG 0415研究表明,mHSPC患者单用新型内分泌治疗25周后,所有患者均未达到去势水平(睾酮< 50ng/dL),且达到主要终点PSA≤0.2 ng/mL的患者比例最低[3]。由此可见,即使在新型内分泌药物广泛使用的当下,使用ADT维持去势水平仍是mHSPC治疗的关键。
在真实的临床诊疗中,也常有患者持有疑问,既然疾病一直控制得很好,那是否有必要持续接受ADT治疗呢?此项会议报道也为我们提供了一些线索,在GETUG-15研究中获得长期生存患者中,逾7成的患者在长达十余年的随访中均持续进行ADT治疗。但我们也注意到,由于持续缓解,有部分患者(28.1%)在治疗期间中止了ADT治疗,这些患者ADT治疗的中位时间为6.3年。然而这些曾中止治疗的患者中有40%又重启了ADT,遗憾的是由于会议报告提供的信息有限,目前尚不得而知这些患者重启ADT的原因,也不清楚这些患者的疾病结局。我们期待未来报告更多此类数据,为我们全面解答该问题。
综合现有的证据,前列腺癌作为激素依赖性肿瘤,无论是否联合其他药物,ADT均是mHSPC中不可或缺的治疗手段,目前各种方案仍应以ADT为基础,将睾酮维持至去势水平。临床研究数据也证实,有相当一部分mHSPC患者在以ADT为基础的方案治疗后能获得长生存,甚至仍处于激素敏感阶段,其中绝大多数患者在十余年的随访中持续使用了ADT。
Abstract LBA70 二甲双胍联合ADT用于mHSPC患者:STAMPEDE研究K臂的总生存(OS)和代谢结果[4]
研究背景
二甲双胍是一种使用广泛且耐受性良好的糖尿病治疗药物。多项研究显示其对包括前列腺癌在内的多种恶性肿瘤具有抗肿瘤活性。ADT是晚期前列腺癌的标准治疗,但有代谢相关的不良反应。本研究假设二甲双胍可减少ADT引起的代谢不良反应,并可能改善OS。
研究方法
在STAMPEDE研究中,无糖尿病的mHSPC患者按1:1随机分配至标准治疗组(A臂)或标准治疗+二甲双胍组(K臂)。标准治疗包括ADT±放疗±多西他赛±雄激素受体通路抑制剂(ARPI)。主要终点为OS,目标HR为0.8(92%检验效力,单侧显著性水平5%)。采用Cox回归分析OS,在6、12和24个月时采用线性回归分析代谢指标。
研究结果
2016年9月至2023年3月间,共1874例mHSPC患者随机化分组,两组基线特征均衡:中位年龄69岁,四分位距(IQR)63-73岁;中位PSA水平为84 ng/mL,IQR 24-352 ng/mL;新发患者1758例(94%),复发患者116例(6%)。计划的标准治疗82%为多西他赛,3%为ARPI。
中位随访60个月后,两组OS的HR为0.91(P=0.148;95% CI 0.80-1.03)。标准治疗组和标准治疗+二甲双胍组的中位OS分别为63个月(95% CI 58-69)和69个月(95% CI 63-73),详见图2。在高瘤负荷患者和低瘤负荷患者中,HR分别为0.79(P=0.006;0.66-0.93)和1.0(P=0.992;0.79-1.26),相互作用P值=0.086。

图2. 主要终点:两组患者的OS
对于PFS,总体HR为0.92(P=0.164;0.81-1.04),高瘤负荷和低瘤负荷亚组的HR分别为0.76(P=0.001;0.64-0.89)和1.10(P=0.401;0.88-1.37),相互作用P值=0.006,详见图3。
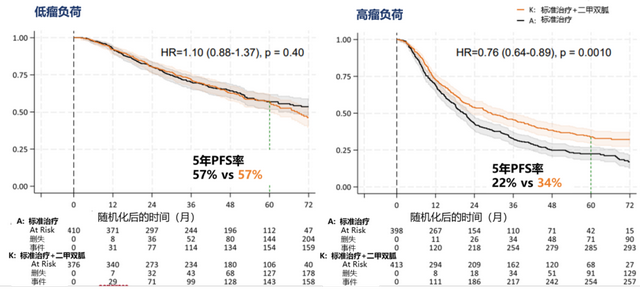
图3. 低瘤负荷和高瘤负荷患者中两组的PFS
二甲双胍显著改善了代谢参数,包括体重增加、空腹血糖、糖化血红蛋白、总胆固醇和低密度脂蛋白胆固醇,发生代谢综合征的患者也更少。标准治疗组和标准治疗+二甲双胍组分别报告了52%和57%的3级以上不良事件,其中二甲双胍增加了胃肠道不良事件。
研究结论
在标准治疗的基础上联合二甲双胍未改善未经选择的mHSPC患者的生存,但可能改善高瘤负荷患者的结局和生存。总体而言,接受二甲双胍治疗的患者代谢参数显著改善。
张墨教授点评
ADT疗效确切,是局部晚期和转移性前列腺癌治疗的基础。但由于其药理作用,也会伴随一系列的副作用,例如心血管、骨骼和代谢风险等。随着新型药物的和联合用药策略的应用,前列腺癌患者的生存期不断延长,因此,预防和管理长期ADT治疗的不良反应日益受到重视。对于其中的代谢风险,包括体重增加、脂质代谢异常、胰岛素抵抗和糖尿病等,亦是临床应关注的重点。对于风险较高的患者,应积极预防应对,如改变生活方式,增加体育活动,改善饮食习惯等。还应定期监测血压、血糖、血脂和BMI等指标,以及进行早期的心血管风险评估,及时干预。
学者们也在不断研究探索安全有效的预防药物,其中二甲双胍作为治疗糖尿病的传统药物,近年来被发现有抗糖尿病以外的众多功效。既往研究发现其对于多种肿瘤均有一定的抗肿瘤作用[5]。因此,STAMPEDE研究在A和K两个臂中探索了在标准治疗的基础上联合二甲双胍能否改善mHSPC患者的肿瘤学结局及代谢相关副作用。本次大会LBA70报告了其结果,尽管二甲双胍未能改善总人群的OS和PFS,但高瘤负荷患者可能从中获益。更重要的是,无论肿瘤负荷高低,接受二甲双胍治疗的患者在体重、空腹血糖、糖化血红蛋白、总胆固醇和低密度脂蛋白胆固醇等代谢参数方面均显示出显著改善。STAMPEDE研究K臂的结果为二甲双胍在接受ADT治疗的前列腺癌患者中的应用提供了重要的临床证据。作为一种耐受性良好且价格低廉的药物,二甲双胍或可成为前列腺癌患者改善代谢并减少去势相关不良反应的一种选择,我们期待未来更多、更大规模的研究提供更多证据。
Abstract LBA68 达罗他胺(DARO)联合ADT在mHSPC患者中的疗效和安全性:III期ARANOTE试验[6]
研究背景
在ARASENS研究中,与ADT+多西他赛相比,DARO+ADT+多西他赛显著改善了mHSPC患者的OS,且两组中治疗相关不良事件(TEAE)的发生率相似。III期全球ARANOTE研究则比较了DARO+ADT与ADT在mHSPC患者中的疗效。
研究方法
经传统影像学确认为mHSPC、ECOG评分0-2、在12周内开始ADT的患者,按2:1随机分配至DARO组(600 mg,每日两次)或安慰剂组,均同时使用ADT。主要终点为影像学无进展生存期(rPFS)。次要终点包括OS、至开始后续抗肿瘤治疗的时间、进展至mCRPC时间、PSA进展时间、疼痛进展时间及安全性。
研究结果
共纳入669例患者(DARO组,N=446;安慰剂组,N=223);中位年龄为70岁;其中31%为亚洲人,9.7%为黑人,基线时中位PSA为21.3 ng/mL,71%的患者为高瘤负荷。
截止2024年6月7日,与安慰剂+ADT相比,DARO+ADT显著改善了rPFS(HR=0.54;95% CI 0.41-0.71;P<0.0001),详见图4。在预先指定的亚组中观察到一致的获益,包括高瘤负荷和低瘤负荷患者。
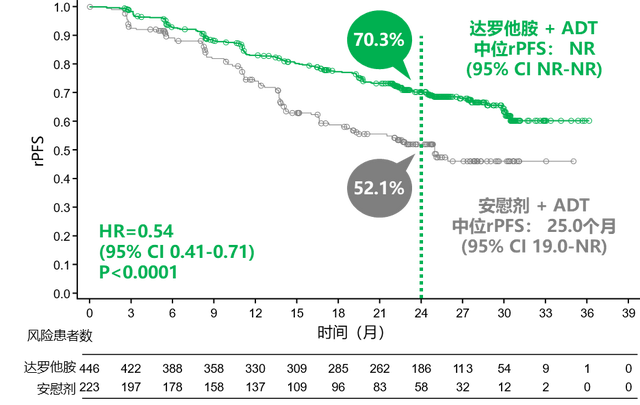
图4. 两组患者的rPFS
DARO与OS获益有正相关的趋势(HR=0.81;95% CI 0.59-1.12),并在所有次要疗效终点中均显示出获益,包括进展至mCRPC时间(HR=0.40;95% CI 0.32-0.51)、PSA进展时间(HR=0.31;95% CI 0.23-0.41)、至后续治疗时间(HR=0.40;95% CI 0.29-0.56)和至疼痛进展时间(HR=0.72;95% CI 0.54-0.96),详见图5。两组TEAE的发生率均较低且相似,因TEAE导致的治疗中断在DARO组中低于安慰剂组(6.1% vs. 9.0%)。
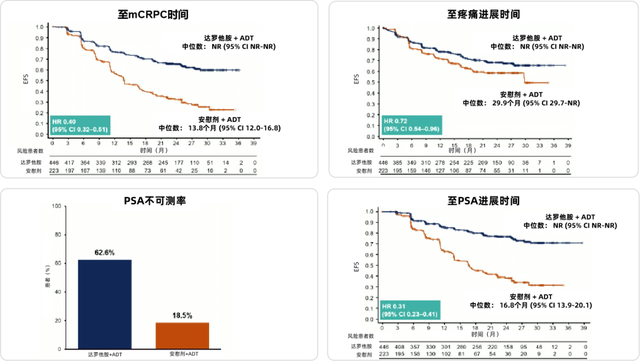 图5. 两组患者次要终点分析:至mCRPC(左上)、至疼痛进展时间(右上)、PSA<0.2 ng/mL的比例(左下)、至PSA进展时间(右下)
图5. 两组患者次要终点分析:至mCRPC(左上)、至疼痛进展时间(右上)、PSA<0.2 ng/mL的比例(左下)、至PSA进展时间(右下)
研究结论
ARANOTE研究证明了DARO在mHSPC中的疗效和良好的耐受性。ARASENS研究和ARANOTE研究表明,无论是否联合化疗,DARO都能为mHSPC患者带来获益,为个体化治疗提供了更多选择,使患者在无疾病进展的情况下获得更长的生存,同时减轻治疗负担。
张墨教授点评
近十余年来,mHSPC的治疗格局发生了巨大变化,目前国内外权威指南一致推荐二联或三联疗法作为mHSPC一线标准治疗。对于mHSPC患者,在临床中若无联合治疗的禁忌证,预期寿命足够从联合治疗中获益,且可耐受不良反应,则应在ADT的基础上积极考虑强化治疗。但不同患者的年龄、身体条件、肿瘤负荷、基础疾病及合并用药均不同,在方案的选择上也有着不同的需求和考虑。近年来各种新药和临床试验蓬勃发展,目前临床上亦有多种可供选择的药物和方案,而本次大会ARANOTE研究又公布了达罗他胺二联方案的有力数据,为临床提供了新的证据和选择。在选择具体方案和药物时,应考虑不同药物的不良反应谱、药物相互作用特征,充分权衡风险与获益,为特定患者选择最合适的治疗方案。而无论采用二联还是三联方案,ADT始终是mHSPC治疗的基础。近年来,临床上最常用的ADT药物——促性腺激素释放激素激动剂(GnRH-a)也在不断推陈出新,发展出多种剂型。目前,国内已有1月、3月和6月不同注射间隔的剂型,为医生和患者提供了新的治疗选择。我们医生在临床中应充分倾听和尊重患者的需求和偏好,在追求疗效的同时也应尽力满足其对生活质量和便利性的需求。
小结
mHSPC的治疗已进入联合治疗时代,各种二联或三联的方案不断涌现,而ADT始终是各种联合方案的基础,发挥着不可或缺的作用。对于ADT一些副作用的风险,应加强患者教育,积极预防和应对。在制定mHSPC治疗方案时应综合考虑患者的年龄、身体状况、肿瘤负荷、合并用药等个体情况,同时综合药物的特性和可及性等因素,科学合理地选择治疗方案。在长期管理中应关注患者对于生活质量和便利性的需求,为患者带来生存与生活质量的双重获益。
参考文献
[1] Sarah Blanchet-Deverly, et al. Long survivors after androgen deprivation therapy (ADT) with or without docetaxel for metastatic castration-sensitive prostate cancer (mCSPC): Long-term follow-up of GETUG-15. ESMO 2024 1627P.
[2] Gravis G, et al. Androgen Deprivation Therapy (ADT) Plus Docetaxel Versus ADT Alone in Metastatic Non castrate Prostate Cancer: Impact of Metastatic Burden and Long-term Survival Analysis of the Randomized Phase 3 GETUG-AFU15 Trial. Eur Urol. 2016 Aug;70(2):256-62.
[3] Maluf FC, et al. A phase 2 randomized clinical trial of abiraterone plus ADT apalutamide, or abiraterone and apalutamide in patients with advanced prostate cancer with non-castrate testosterone levels (LACOG 0415) Eur J Cancer. 2021 Oct 13:158:63-71.
[4] Silke Gillessen, et al. Adding metformin to androgen deprivation therapy (ADT) for patients (pts) with metastatic hormone sensitive prostate cancer (mHSPC): Overall survival (OS) results from the multi-arm, multi-stage randomised platform trial STAMPEDE. ESMO 2024. LBA70.
[5] Coyle C, et al. Metformin as an adjuvant treatment for cancer: a systematic review and meta-analysis. Ann Oncol. 2016 Dec;27(12):2184-2195.
[6] F. Saad,et al. Efficacy and safety of darolutamide plus androgen-deprivation therapy (ADT) in patients with metastatic hormone-sensitive prostate cancer (mHSPC) from the phase 3 ARANOTE trial. ESMO 2024 LBA68.
声明
本视频/资讯/文章是由益普生医学团队编辑/医疗卫生专业人士撰写提供,旨在用于医疗卫生专业人士间的学术交流,不支持以任何形式转发给非医疗卫生专业人士;如有违反,责任自负;转发给其他医疗卫生专业人士时,也请自觉保护知识产权。
本视频/资讯/文章的内容不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。内容中出现任何药品并非为广告推广目的,医疗卫生专业人士如进行处方,请严格遵照该药品在中国批准使用的说明书。益普生不承担任何相关责任。
DIP-CN-012383 有效期至2025年9月25日
审核:Kristen
排版:Gardenia
执行:Gardenia
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。
