大家好!今天来了解一项“以二氟甲基阴离子化学为主导的脱氟官能团化方法”——《Defluorinative functionalization approach led by difluoromethyl anion chemistry》发表于《nature communications》。有机氟化合物在多领域应用广泛,然而PFAS问题引发诸多担忧,欧盟对三氟甲基监管趋严,寻找替代官能团迫在眉睫。在此背景下,以二氟甲基阴离子化学为主导的脱氟官能团化方法研究应运而生。它致力于解决 C (sp³)–F 键转化难题,通过一系列实验探索,在反应条件优化、亲电体与底物拓展等方面取得成果,为药物和农用化学品研发带来新曙光,接下来让我们深入了解。
*本文只做阅读笔记分享*
一、研究背景
有机氟化合物在制药、农用化学品和材料领域占据着举足轻重的地位,这得益于氟原子的引入赋予了它们独特的性质。然而,近年来全氟和多氟烷基物质(PFAS)引发的环境和健康问题不容忽视。同时,欧盟在2023年发布的新指南将三氟甲基纳入PFAS法规范围,预示着未来对含三氟甲基化合物的监管会愈发严格,寻找替代官能团迫在眉睫。在这种背景下,二氟甲基作为一种有潜力的取代基脱颖而出,它具有类似三氟甲基的性质,同时还能作为氢键供体和醚、硫醇的生物电子等排体,为药物和农用化学品的研发带来了新的机遇。但实现从三氟甲基到二氟甲基的转化并非易事,C(sp³)–F键的转化面临着选择性和官能团耐受性等诸多挑战,这也正是这项研究致力于解决的问题。
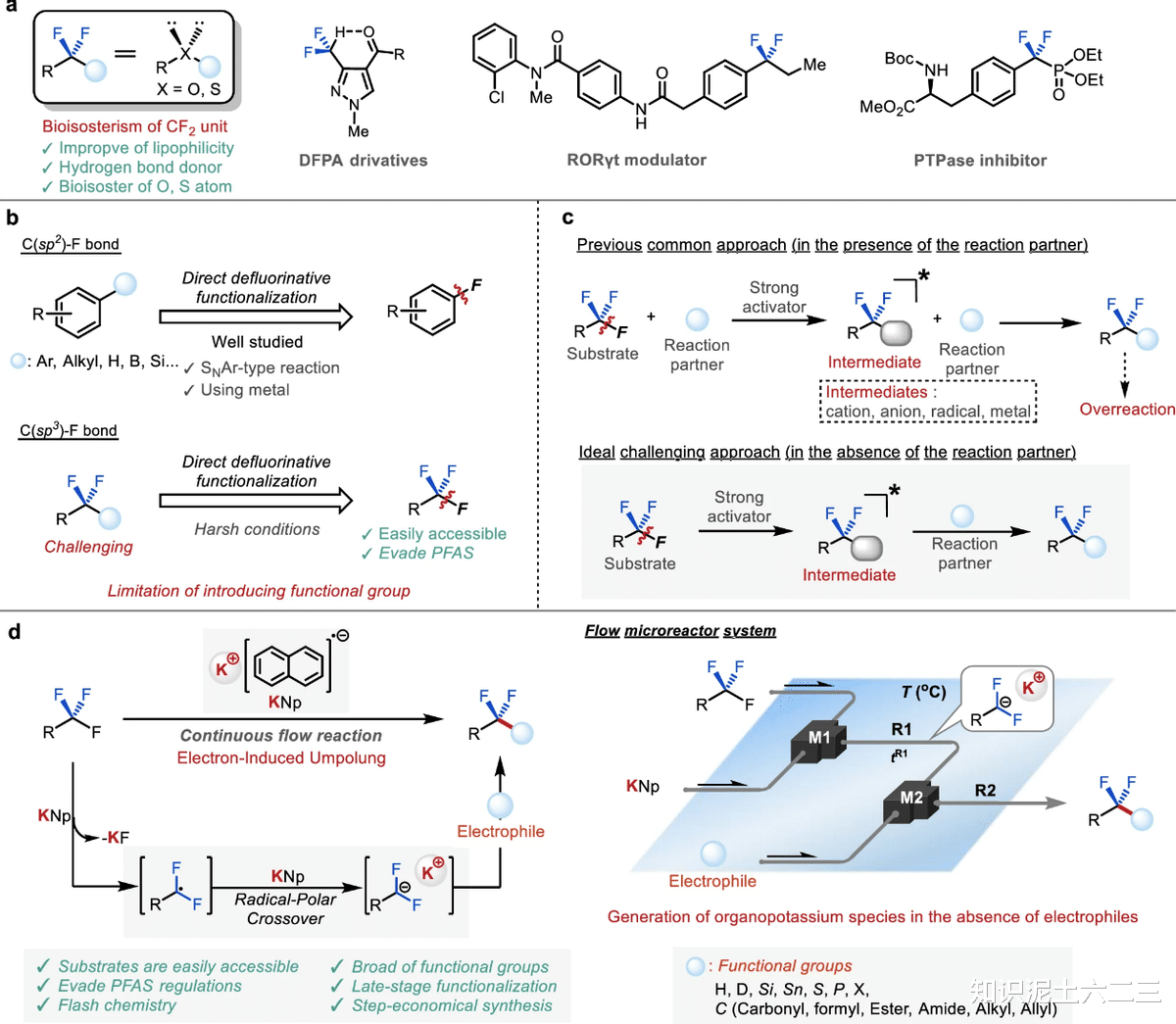
二、实验过程与结果
(一)概念验证与优化
1、碱金属萘化物的评估
最初以甲醇为亲电体,在常规间歇反应中评估碱金属萘化物(MNp)对三氟甲基化合物C(sp³)–F键断裂和极性反转的能力。大家看这张图,在对苯三氟甲烷(1a)的氢脱氟反应中,我们发现不同碱金属萘化物的效果差异明显。其中,钾萘(KNp)表现最佳,这是因为MNp不仅具有强有机自由基还原性能,而且价格实惠、制备容易。其萘阴离子的还原电位为–3.10V,虽然包含抗衡阳离子时还原电位会降低(E>-3.10V),但三氟甲基芳烃的还原电位约为–2.50V,我们推测三氟甲基化合物会发生双电子还原反应。

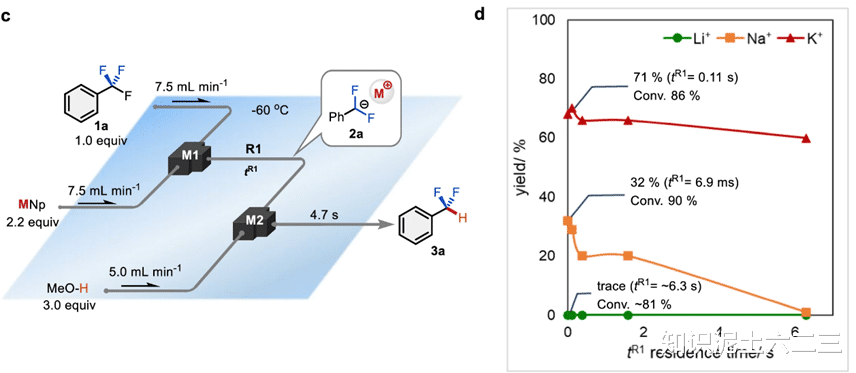
2、无亲电体条件下的研究
接着,尝试在无亲电体的情况下进行反应。在间歇反应器中,生成二氟甲基阴离子等不稳定中间体非常困难。但流动微反应器为我们带来了转机。当我们使用锂作为碱金属阳离子时,1a的转化率大幅下降,几乎只能得到微量产物;而使用钠和钾等较软碱金属阳离子时,二氟甲基苯的产率显著提高,尤其是钾,效果最为突出。这是因为钾阳离子能够提高二氟甲基阴离子中间体的稳定性,这一结果与密度泛函理论(DFT)计算的碱金属阳离子对氟甲基阴离子衍生物稳定性的影响一致。
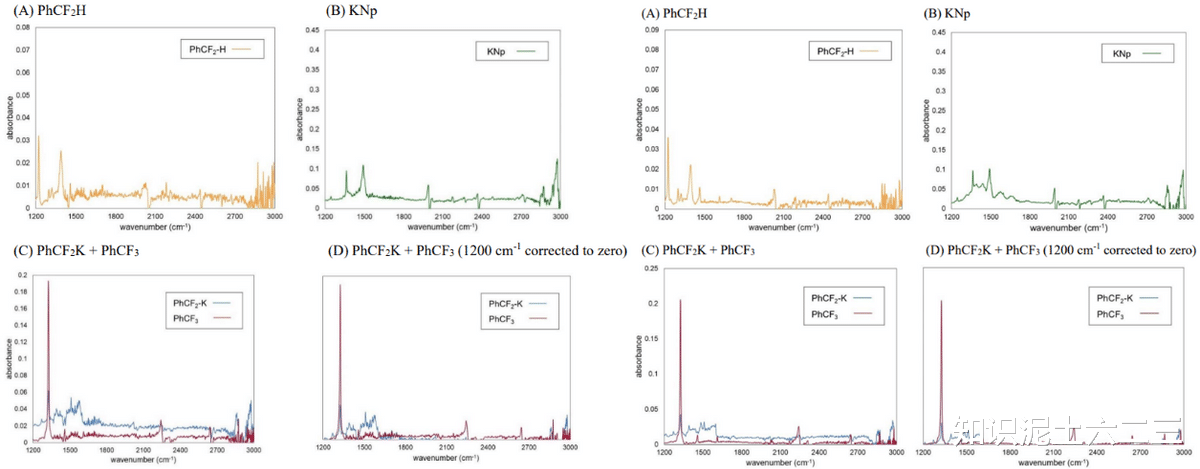
为了进一步证实二氟甲基阴离子中间体的形成,通过在线红外光谱监测,发现1a在1325cm⁻¹处的峰显著降低,同时出现了归属于2a的1510和1598cm⁻¹两个峰,DFT计算也表明在该区域应出现两个特征峰(1524和1640cm⁻¹),有力地证明了中间体的生成。此外,我们还发现使用1,2-二甲氧基乙烷(DME)作为配位共溶剂可以进一步提高反应的转化率和产率。
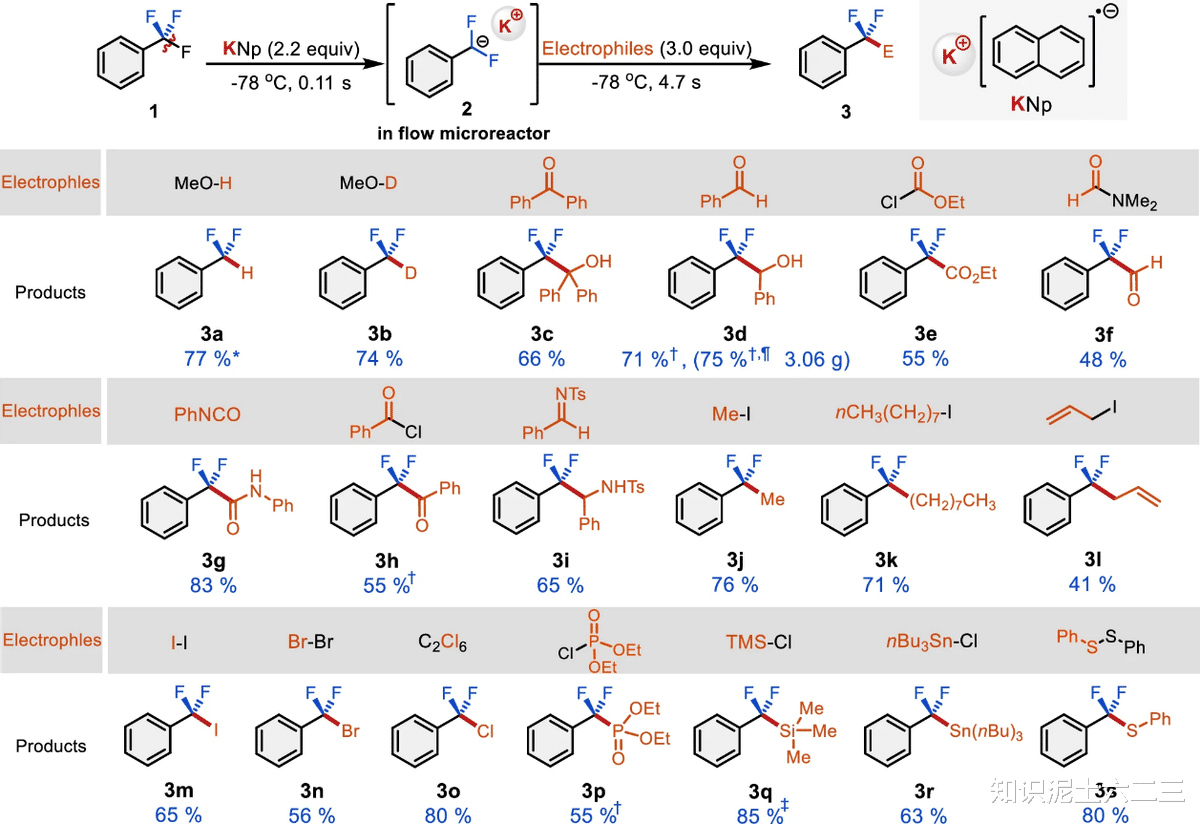
(二)亲电体和底物范围的探索
1、亲电体的引入
在确定了反应条件后,探索了除氢以外的亲电体引入的可能性。甲醇-d₂能够以良好的产率转化为目标产物(3b),这表明引入的质子来自甲醇,而非溶剂或其他质子源。含羰基亲电体(如3c-3h)也能顺利反应,得到相应的目标产物,并且成功实现了3d的克级合成,在连续操作23分钟后,获得了3.06g的产物。
亚胺(3i)同样适合作为亲电体参与反应。在这个过程中,我们还发现使用不同的亲电体对反应结果有重要影响。例如,当使用苯甲酰氯和三氟甲基底物1a进行反应时,底物1a定量回收,这表明强还原性的KNp对苯甲酰氯的还原速度比与底物的脱氟反应速度更快,从而突出了在无亲电体存在下生成和控制二氟甲基阴离子的重要性。
此外,初级烷基碘(3j-3l)也能成功引入,得到具有R-CF₂烷基单元(醚部分的生物电子等排体)的产物,且该反应在引入长链烷基时,相比使用有机锂物种,使用有机钾物种能提高选择性。同时,还能以中等产率引入含磷酰基、卤素、硅基、锡基和硫基等杂原子官能团(3m-3s),这些官能团在药物研究中都具有重要意义。
不过,硼衍生物(如2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧硼戊环和硼酸三异丙酯)作为亲电体时,反应并不合适,可能是因为生成的在苄基位置含氟原子和硼基的产物不稳定,容易分解。
2、底物范围的拓展
进一步研究各种苯三氟甲烷衍生物的氢脱氟反应范围,以评估流动体系的通用性。

多种含氟芳基衍生物都能在该流动体系中顺利实现氢脱氟反应。含甲基、甲氧基、苯基等常见官能团的底物(4a-4d)能够毫无问题地转化为相应的二氟甲基芳烃。即使是含质子或亲电官能团及吡啶衍生物的底物(4f-4i),也能以中等至良好的产率得到目标产物。值得注意的是,苯乙烯衍生物虽然在还原金属化试剂作用下即使在流动条件下也容易发生低聚反应,但我们的流动方法能够实现其C(sp³)–F键的选择性断裂。含C(sp²)–F键或其他C(sp³)–F键的底物(4j-4l)也能以高化学选择性和良好产率得到氢脱氟产物。此外,游离羟基和氨基取代的底物(4m-4p)也能成功断裂C(sp³)–F键,得到相应的产物。更令人惊喜的是,二氟甲基苯(4q)也能发生氢脱氟反应,生成氟甲基苯,这表明顺序断裂多个C(sp³)–F键将实现更灵活的分子转化。
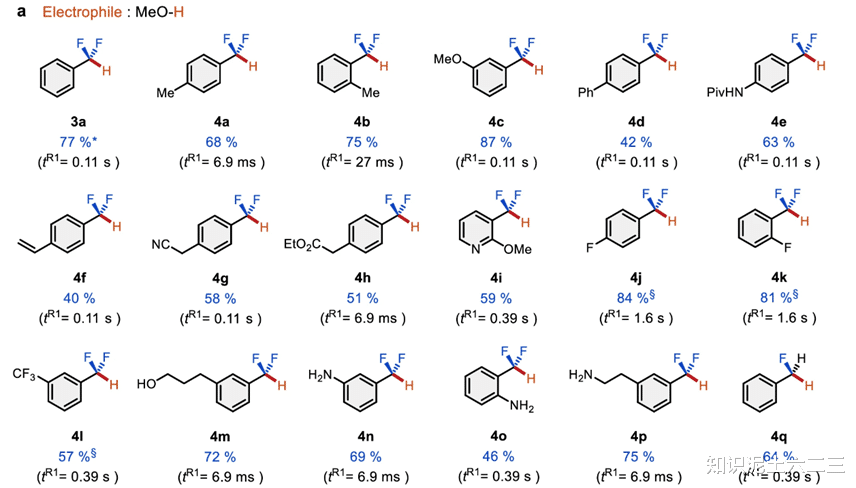
为了深入了解反应机理,还进行了自由基钟实验。以2-烯丙基(三氟甲基)苯为底物,在我们的反应条件下,没有得到分子内环化产物(4r’或4r”),而是得到了氢脱氟产物(4r),这说明反应中第二次单电子转移非常快。

三、实际应用
(一)后期官能团化(LSF)
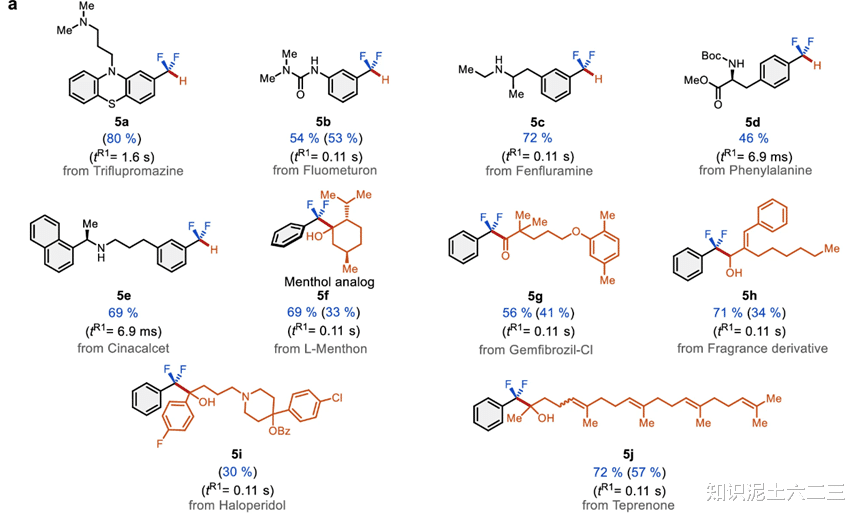
将该方法应用于后期官能团化(LSF),这在药物发现中具有重要意义。吩噻嗪类药物三氟丙嗪在这种方法下,能够以优异的产率得到相应的二氟甲基化合物(5a)。除草剂氟草隆、血清素激动剂芬氟拉明等含取代氨基的分子(5b、5c),以及氨基酸L-苯丙氨酸、钙受体激动剂西那卡塞(5d、5e)也都能顺利进行氢脱氟反应。这表明我们的方法能够对复杂生物活性分子中的C(sp³)–F键进行有效的转化。
还实现了三氟甲基苯与含亲电官能团的生物活性底物的脱氟交叉偶联反应。例如,L-薄荷酮反应后可得到氟化薄荷醇类似物(5f),纤维酸类药物吉非罗齐、香料、氟哌啶醇、替普瑞酮等含复杂官能团的亲电体也都能作为底物参与反应(5g-5j),进一步展示了该方法在药物研发中的广泛适用性。
(二)制药中间体的合成
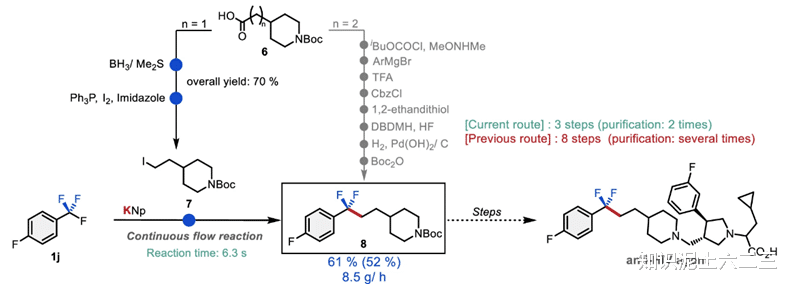
我们以抗HIV药物关键中间体二氟烷基化合物8的合成为例,来展示该方法在制药中间体合成中的优势。从市售羧酸6出发,经两步合成吡咯烷衍生物7,然后化合物8可在约6.3秒内直接获得。与之前Merck提出的八步合成序列相比,我们的方法显著减少了合成步骤和时间,同时无需使用有毒试剂,并且能够以约8.5gh⁻¹的高生产率提供相应的合成中间体,极大地提高了合成效率。
四、研究总结
综上所述,成功开发了一种在流动体系中通过二氟甲基阴离子实现C(sp³)–F键官能团化的方法。通过钾萘对三氟甲基化合物进行瞬时电子诱导极性反转,并利用流动微反应器严格控制停留时间,我们能够高效地获得各种二氟甲基化合物。这一方法为药物和农用化学品的发现提供了一种步骤和时间经济的LSF方法,具有重要的科学意义和应用价值。它不仅克服了以往C(sp³)–F键转化中的诸多挑战,如选择性和官能团耐受性问题,还为合成具有潜在生物活性的化合物提供了新的途径。
五、一起来做做题吧
1、欧盟在 2023 年对三氟甲基相关规定的变化是因为( )
A. 三氟甲基本身具有高毒性
B. 三氟甲基化合物合成困难
C. 全氟和多氟烷基物质(PFAS)引发环境和健康问题,三氟甲基被纳入其监管范围
D. 三氟甲基在药物研发中作用逐渐减小
2、与三氟甲基相比,二氟甲基的优势不包括以下哪点( )
A. 可作为氢键供体
B. 是醚和硫醇的生物电子等排体
C. 完全没有环境和健康风险
D. 具有类似三氟甲基的性质且能调节亲脂性
3、在对苯三氟甲烷(1a)的氢脱氟反应中,碱金属萘化物(MNp)中哪种金属效果最佳( )
A. 锂
B. 钠
C. 钾
D. 无法确定
4、在无亲电体条件下,使用流动微反应器研究碱金属阳离子对反应的影响时,发现( )
A. 锂阳离子使 1a 转化率大幅提高
B. 钾阳离子使二氟甲基苯产率显著降低
C. 钠阳离子对反应无明显影响
D. 锂阳离子导致 1a 转化率大幅下降
5、以下哪种亲电体不适合用于该脱氟官能团化反应( )
A. 甲醇 - d₂
B. 苯甲酰氯
C. 硼酸三异丙酯
D. 初级烷基碘
6、在底物范围拓展中,哪种类型的底物能在该流动体系中实现氢脱氟反应( )
A. 仅含常见官能团(如甲基、甲氧基、苯基)的底物
B. 仅含游离羟基和氨基取代的底物
C. 多种含氟芳基衍生物,包括含不同官能团和结构特点的底物
D. 仅含 C (sp²)–F 键或其他 C (sp³)–F 键的底物
7、在后期官能团化(LSF)应用中,以下哪种分子不能进行氢脱氟反应( )
A. 三氟丙嗪
B. 氟草隆
C. 某种不含 C (sp³)–F 键的简单烷烃
D. L - 苯丙氨酸
8、该研究在制药中间体合成方面的优势不包括( )
A. 减少合成步骤
B. 提高反应产率
C. 必须使用有毒试剂
D. 缩短反应时间
参考文献:
Muta, K., H. et al. Defluorinative functionalization approach led by difluoromethyl anion chemistry. Nat Commun 16, 416 (2025).