【CMT&CHTV 文献精粹】
导语:本文深入探讨了麻醉剂对意识的抑制作用及其从麻醉中苏醒的神经生物学基础。通过对动物模型的研究,揭示了麻醉剂如何通过特定的分子靶点和神经回路影响大脑活动,进而调控意识状态。
研究背景
麻醉剂在医学手术中的应用已有百余年历史,但其如何影响意识的机制仍是有待探究的科学领域。早期的脂质理论认为麻醉剂通过溶解在细胞膜的脂质中发挥作用,但随着研究的深入,这一理论逐渐受到质疑。近年来,分子药理学的进步揭示了麻醉剂可能通过作用于特定的蛋白质靶点,如GABAA受体、NMDA受体等,影响神经信号的传递。此外,神经回路理论也表明,麻醉剂的作用可能涉及特定的神经解剖学位点。尽管如此,麻醉苏醒的具体机制仍不完全清楚,这限制了麻醉管理的优化和患者术后恢复的改善。
2024年3月,Trends in Neurosciences杂志发表了题为“Neurobiological basis of emergence from anesthesia”的文章,深入探讨了麻醉剂如何通过分子和神经回路机制影响意识的恢复。

研究设计
本研究是一项基于动物模型的实验研究,旨在探讨麻醉剂如何通过分子和神经回路机制影响意识的恢复。研究使用了包括异氟醚、丙泊酚、氯胺酮和戊巴比妥多种麻醉剂,通过观察动物模型在麻醉状态下的神经活动和行为反应,评估麻醉剂的作用。研究特别关注了大脑中特定区域,如腹后内侧核(VPM)的K+/Cl–共转运蛋白2(KCC2)的表达变化,以及这些变化如何影响神经元的兴奋性和意识状态。研究还利用了化学遗传学、光遗传学和电刺激等技术,操纵特定的神经回路,以揭示其在麻醉苏醒中的作用。
研究结果
麻醉剂对意识的快速影响
研究揭示了麻醉剂如何迅速影响意识状态。通过动物模型的观察,研究者发现在麻醉剂作用下,大脑的VPM区域KCC2表达显著下调。具体数据显示,在多种麻醉剂(包括异氟醚、丙泊酚、氯胺酮和戊巴比妥)的影响下,VPM区域的KCC2水平在LORR(失去矫正反射)发生后不久即开始下降,并在整个MRS(最小反应状态)期间持续降低。这种下调过程与麻醉剂引起的意识水平下降密切相关。
分子机制
进一步的分子机制研究表明,KCC2的下调是通过泛素-蛋白酶体途径实现的,由E3泛素连接酶Fbxl4驱动。实验中,KCC2在Thr1007位点的磷酸化促进了其与Fbxl4的相互作用,导致KCC2的快速降解(图1)。这一过程是GABAA受体介导的去抑制,加速了VPM神经元的兴奋性恢复,从而促进了意识的恢复。

图1 小鼠模型研究中KCC2在麻醉苏醒中的作用
神经回路的调控作用
研究还发现,特定的神经回路在麻醉苏醒中起着关键作用(图2和图3)。通过化学遗传学、光遗传学和电刺激等技术,激活特定的神经回路,如基底前脑-前额叶皮质回路、黑质-腹侧被盖区多巴胺能神经元等,可以显著加速麻醉苏醒。例如,光遗传学激活VTA-NAc(腹侧被盖区-核伏隔区)多巴胺能神经元,以及化学遗传学激活LC-NE(蓝斑-去甲肾上腺素)神经元,均能加速从异氟醚、七氟醚或地氟醚麻醉中的苏醒。
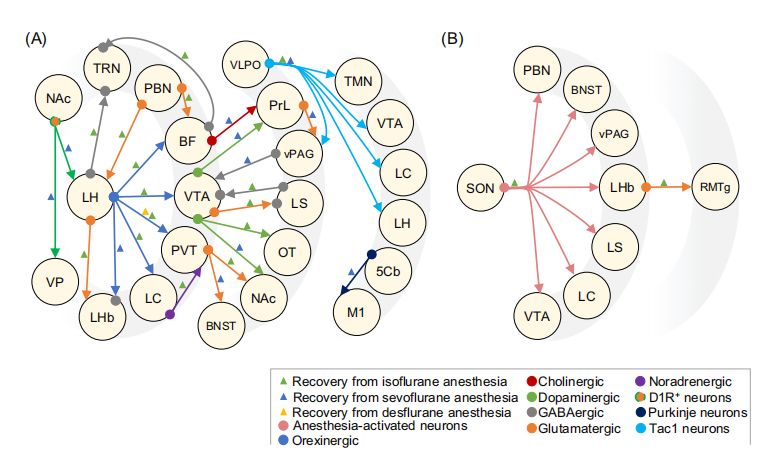
图2 动物模型中加速麻醉苏醒的神经回路
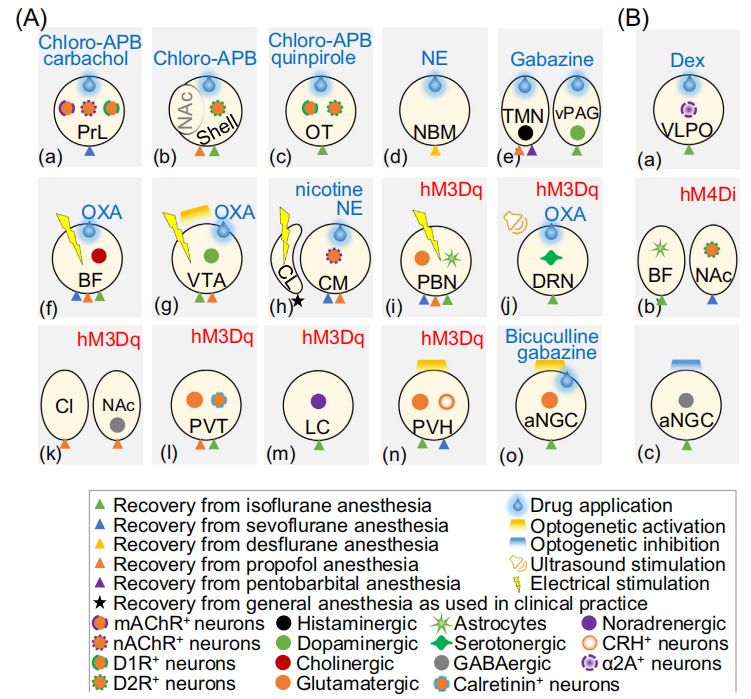
图3 动物模型麻醉后苏醒的细胞核变化
神经抑制与苏醒的关联
对特定神经回路的抑制则会延迟苏醒。例如,向PFC(前额叶皮质)微注tetrodotoxin (TTX) 以抑制神经活动,能够延迟从七氟醚麻醉中的苏醒。此外,研究还发现,尼古丁或抑制Kv1.2在大鼠CM(中央内侧丘脑)中的作用可以逆转七氟醚或地氟醚麻醉。
总结讨论
本研究提供了麻醉苏醒机制的新见解,强调了大脑内在的分子和神经回路在调控意识恢复中的关键作用。研究结果表明,通过操纵特定的神经回路,可以加速或延缓麻醉苏醒,这对于优化临床麻醉管理具有重要意义。然而,麻醉苏醒的机制仍有许多未知之处,未来的研究需要进一步探索这些分子和神经回路如何相互作用,以及它们在不同麻醉剂和不同患者群体中的作用。此外,研究还提出了一些重要的未解决问题,如麻醉苏醒与自然睡眠觉醒的神经生物学差异,以及如何通过这些机制改善术后患者的恢复。
参考文献
SONG XJ, HU JJ. Neurobiological basis of emergence from anesthesia[J]. Trends Neurosci. 2024, 47(5):355-366. doi:10.1016/j.tins.2024.02.006.
“医学论坛网”发布医学领域研究成果和解读,供专业人员科研参考,不作为诊疗标准,使用需根据具体情况评估。
编辑:且行
二审:耳东
三审:清扬
排版:半夏