
1.背景
肺肉瘤样癌(Pulmonary sarcomatoid carcinomas,PSC)是一种非常少见(发病率约占0.1~0.4%)、恶性程度极高的高度异质性非小细胞肺癌(NSCLC),侵袭性强、预后差、术后易复发且临床表现无特异性。肺肉瘤样癌对放化疗敏感性差,随着靶向药物及免疫检查点抑制剂在肿瘤治疗中的快速发展,肺肉瘤样的治疗也正逐步向精准靶向治疗及免疫治疗领域探索[1-2]。
2.分子特征
国内学者对PSC患者分子特征进行研究分析[3],28%的PSC患者携带EGFR突变,但是大多数突变为罕见突变(如D1014G、V845M、G485S、K757R、L861Q等),22%的PSC患者携带KRAS激活突变,包括G12C/V和Q61K。16%的PSC患者携带MET突变,主要包括MET基因14外显子跳跃突变(MET 14跳突)、13del和H904N(图1)。

图1.中国人群肺肉瘤样癌突变图谱
Kwon HJ在其研究中纳入31例PSCs患者[4],其中11例同时具有原发及转移灶组织。对以上患者全部样本进行全外显子测序,并进行PD-L1免疫组化、基于数字PCR的MET 14跳突检测。结果显示TP53为原发灶(77%)和转移灶(73%)中最常见的变异基因,大约三分之一的原发PSC患者检出可操作变异,例如EGFR (29%), KRAS(6%),ALK(6%)和MET外显子14跳跃突变(19%)。其中MET 14跳突与TP53突变存在互斥关系;而MET 14跳突通常与MDM2扩增伴随发生(图2)。
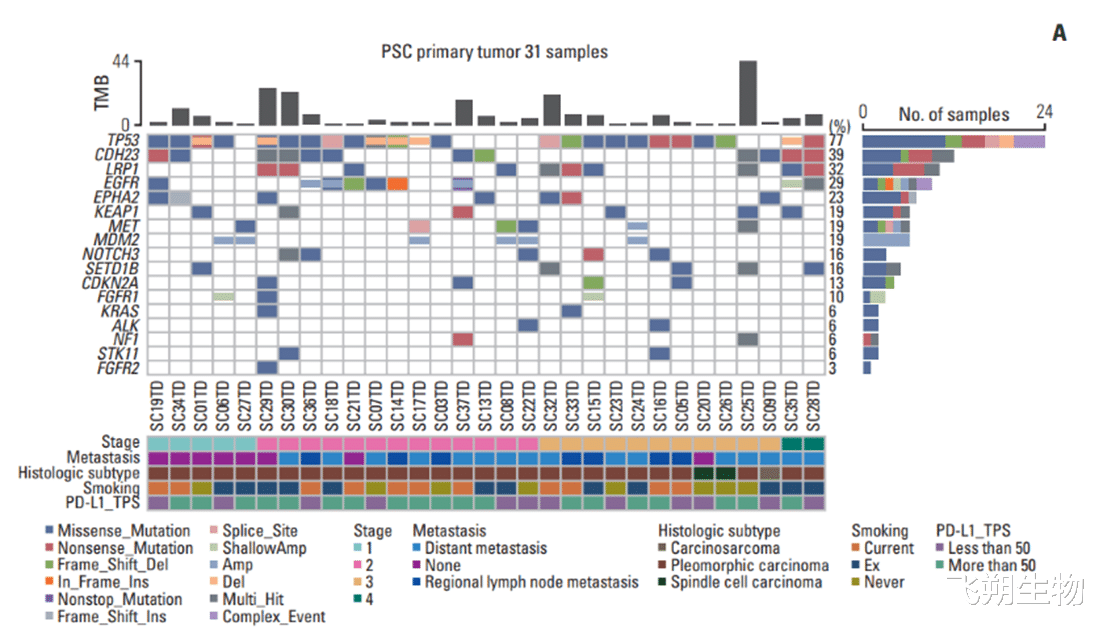

图2.肺肉瘤样癌的突变图谱。原发灶(A)和转移灶(B)的全外显子组测序结果。
总而言之,与其它类型肺癌相比,PSC中MET突变率明显较高,且PD-L1蛋白表达较强。
3.靶向治疗
MET基因的改变,包括MET 14跳突以及MET基因的扩增和过表达。MET 14跳突是最常见和研究最充分的突变类型。且现有临床资料证实了MET-TKI对MET改变的PSC患者的疗效,其中赛沃替尼临床注册研究中入组PSC患者比例为迄今为止最大的,纳入70名MET ex14跳跃突变的晚期 NSCLC患者,其中PSC患者占比36%。结果显示,在PSC亚组中,赛沃替尼治疗后PFS达5.5个月,OS达10.6个月,该结果证实赛沃替尼为PSC患者提供了坚实可靠的治疗方案选择[5]。
Tsuda T在其研究中评价了不同驱动基因之间的靶向治疗疗效[6]。5例存在驱动基因变异的患者中,接受吉非替尼治疗的2例患者PFS分别为1.3个月和1.6个月。2例ALK融合变异的患者在接受克唑替尼治疗后的PFS分别为2.1和14.0个月,1例MET 14跳突的患者接受特泊替尼治疗后的PFS为9.7个月。
不同基因突变对靶向治疗的反应各不相同,且治疗效果存在个体差异。目前,针对肺肉瘤样癌的靶向治疗仍在不断探索中,需要进一步的研究来确定更有效的治疗方案。
4.免疫治疗
考虑到PD-L1在PSC中存在较高表达,免疫治疗或可为该罕见亚型提供更多预后保障。国内一项多中心研究评估分析了免疫及免疫联合治疗在PSC中的疗效[7]。
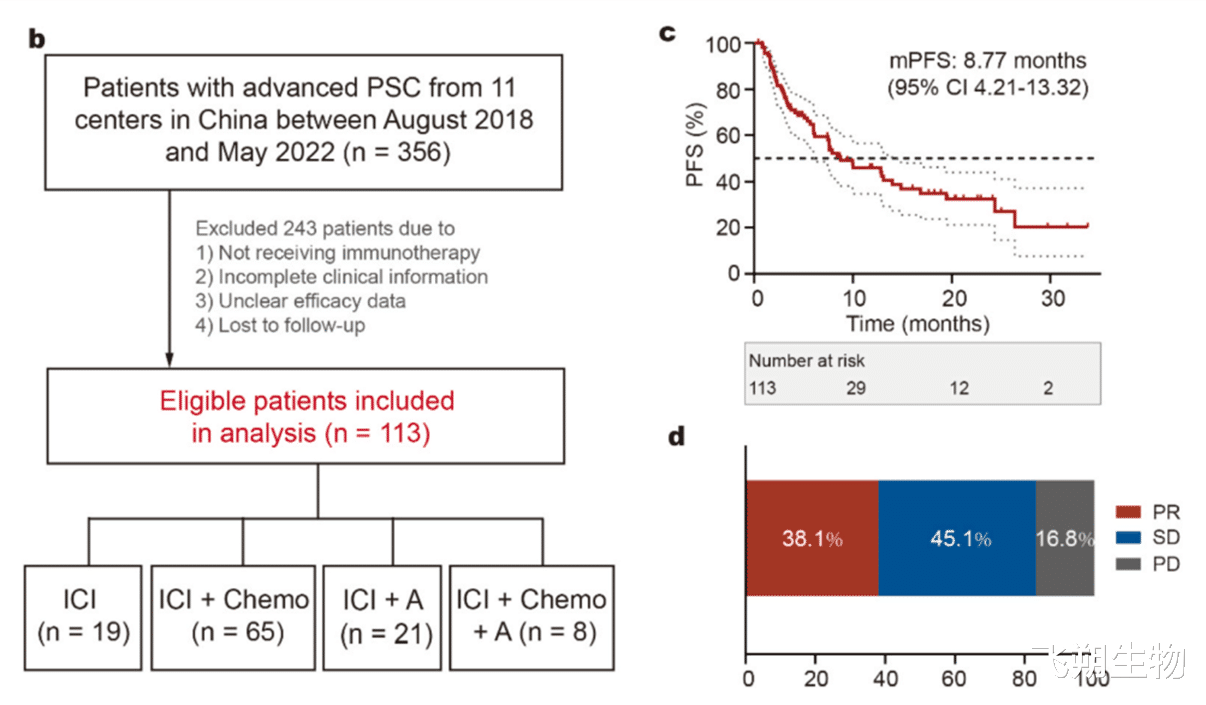
图3.113例PSC的免疫治疗方案及生存分析结果
113例PSC患者中位随访时间为12个月,中位PFS为8.77个月,其中43例(38.1%)发生PR, 51例(45.1%)发生SD,(16.8%)经历PD, ORR和DCR分别为38.1%和83.2%(图3)。不同分组治疗疗效对比中发现ICIs联合抗血管生成药物显著提高PFS (p = 0.04)(图4c)。
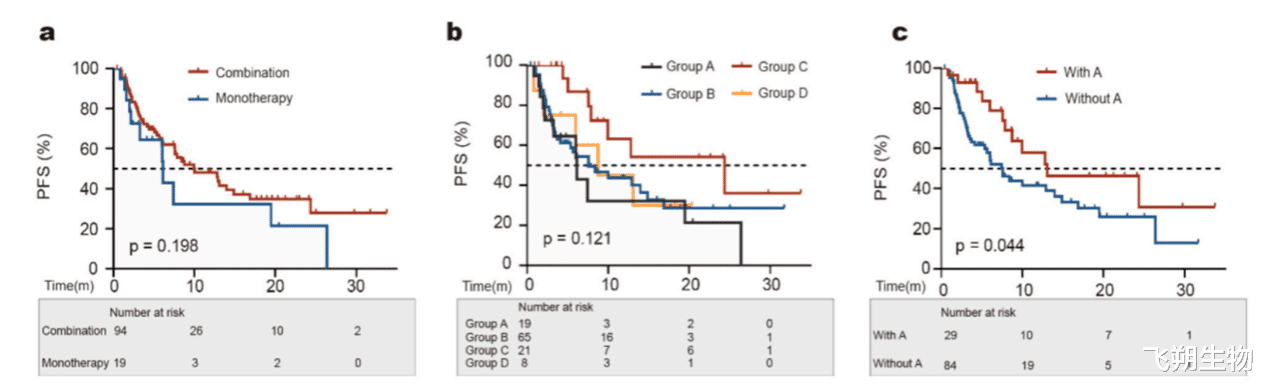
图4.不同治疗策略之间的生存差异对比。A组:单独接受ICI、B组:ICI +化疗、C组:ICI +抗血管生成治疗、D组:ICI +化疗+抗血管生成治变图谱。原发灶(A)和转移灶(B)的全外显子组测序结果。
5.总结与展望
PSC是NSCLC罕见的病理类型,但其生物学特点及临床特征不同于其他类型的NSCLC,该癌种对传统的放化疗治疗不敏感,预后差。 随着分子生物学的发展,目前靶向治疗和免疫治疗也逐渐在PSC领域崭露头角,也预示着PSC的治疗开始了精准治疗的模式,同时也为后续大型临床研究的开展提供依据。
参考文献
[1]Gong T, Jia B, Chen C, Zhang Z, Wang C. Clinical analysis of 78 pulmonary sarcomatoid carcinomas with surgical treatment. J Int Med Res. 2022 Oct;50(10):3000605221128092.
[2]Zhang WH, Lin J. Advances in the diagnosis and treatment of pulmonary sarcomatoid carcinomas [J]. J Cancer Control Treat, 2023,36(9):732-737.
[3]Liang X, Li Q, Xu B, Hu S, Wang Q, Li Y, Zong Y, Zhang S, Li C. Mutation landscape and tumor mutation burden analysis of Chinese patients with pulmonary sarcomatoid carcinomas. Int J Clin Oncol. 2019 Sep;24(9):1061-1068.
[4]Kwon HJ, Lee S, Han YB, Lee J, Kwon S, Kim H, Chung JH. Genomic Landscape of Pulmonary Sarcomatoid Carcinoma. Cancer Res Treat. 2024 Apr;56(2):442-454.
[5]Gong C, Xiong H, Qin K, Wang J, Cheng Y, Zhao J and Zhang J (2022) MET alterations in advanced pulmonary sarcomatoid carcinoma. Front. Oncol. 12:1017026.
[6]Tsuda T, Ichikawa T, Matsumoto M, Mizusihima I, Azechi K, Takata N, et al. An observational study on the efficacy of targeted therapy for pulmonary sarcomatoid carcinoma. Discov Oncol. 2024 Aug 29;15(1):382.
[7]Xie M, Chu T, Dong X, Wang H, Chu Q, Cai X, Wang J, Yao Y, Wu L, Ye F, Zhu B, Zhou C, Su C. Heterogeneity in advanced pulmonary sarcomatoid carcinoma and its efficacy to immune checkpoint inhibitors. Eur J Cancer. 2024 Sep;209:114260.
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!