*仅供医学专业人士阅读参考
点击右上方“关注”,准时接收每日精彩内容推送。
肌肉骨骼系统,尤其是肌腱与骨骼的界面,在人体运动功能中发挥着重要作用。肌腱-骨骼界面是肌腱插入骨骼的地方。它由肌腱、纤维软骨和骨组成,这些相邻组织之间存在渐变和连续的过渡。这些具有独特结构的界面可有效缓解应力集中。当发生损伤时,由于生理结构复杂,再生能力差,临床手a术治疗往往会形成疤痕组织而不是自然界面,导致再次损伤的可能性很高。在肌腱-骨损伤修复领域,传统生物材料的生物活性单一,只能促进骨结合或肌腱成熟。最近,一些双相或多相支架被开发出来,可同时作用于界面上的多种组织。肌腱-骨骼损伤患者因丧失自然结构而运动受限,这阻碍了他们的康复。传统的生物材料侧重于加强肌腱/骨骼的再生能力,以恢复自然结构。然而,由于忽视免疫环境和缺乏多组织再生功能,令人满意的结果仍然难以实现。
来自中国科学院上海硅酸盐研究所的吴成铁团队将硅酸锰(MS)纳米颗粒与肌腱/骨相关细胞相结合,制作了免疫调节多细胞支架,用于肌腱到骨的综合再生。值得注意的是,通过整合仿生细胞分布和 MS 纳米粒子,多细胞支架表现出多种生物活性。此外,MS 纳米颗粒通过调节巨噬细胞增强了多细胞支架的特异性分化,这主要归因于锰离子诱导巨噬细胞分泌 PGE2。此外,三项动物实验结果表明,多细胞支架实现了免疫调节、综合再生以及肌腱与骨界面的功能恢复。因此,基于无机生物材料的多细胞支架为软/硬组织界面的免疫调节和综合再生提供了一种创新概念。相关工作以题为“Immunomodulatory multicellular scaffolds for tendon-to-bone regeneration”的文章发表在2024年03月08日的国际顶级期刊《Science Advances》。

1. 创新型研究内容
本研究成功开发了一种基于硅酸锰(MS)纳米颗粒的多细胞支架,用于肌腱-骨损伤的免疫调节和综合再生。具体来说,肌腱干/祖细胞(TSPCs)和骨髓间充质干细胞(BMSCs)以分层方式分布在支架中,实现了肌腱与骨界面的模拟(图 1)。得益于多细胞分布和MS纳米颗粒,多细胞支架在体外显示出良好的免疫调节能力和腱-骨一体化再生潜力。将多细胞支架植入家兔和大鼠肩袖撕裂处(RCTs),可同时实现免疫调节、界面微结构恢复和功能恢复。随后,还将基于 MS 纳米粒子的多细胞支架植入巨噬细胞耗竭的大鼠体内,进一步揭示了免疫调节过程在支架特异性分化中的作用。此外,还深入研究了锰离子通过免疫调节促进肌腱-骨界面再生的机制。总之,免疫调节多细胞支架的构建为软硬组织界面的综合再生提供了一种前景广阔的策略。

图1 基于 MS 纳米粒子的免疫调节多细胞支架示意图,可用于肌腱到骨骼的一体化再生
【3D生物打印多细胞支架的构建与表征】
首先,本研究根据先前的研究合成了 MS 纳米颗粒和甲基丙烯酰明胶(GelMA)。扫描透射电子显微镜(STEM)图像显示,MS 纳米颗粒是直径接近 100 nm 的空心球体(图 2A)。此外,能量色散光谱显示,锰和硅元素在 MS 纳米颗粒中均匀分布。X 射线衍射(XRD)图表明,MS 纳米粒子被分度为 (Mn2O3)3MnSiO3(PDF #41-1367)(图 2B)。因此,上述结果证实了 MS 纳米粒子的成功制备。接下来,将 MS 纳米粒子以不同的质量比(0、2、5、10 和 15%)加入到 GelMA 水凝胶中,制成一系列复合油墨,分别命名为 GelMA、GelMA-2MS、GelMA-5MS、GelMA-10MS 和 GelMA-15MS(图 2C)。如图 2D 所示,打印适性分析表明,各组的实际值与理论值的近似程度与加入的 MS 纳米粒子的浓度呈正相关,这表明加入 MS 纳米粒子可改善纯 GelMA 水凝胶的打印适性。
随后,为了在分层结构和细胞组成方面模拟肌腱与骨的界面,本研究将 BMSCs 和 TSPCs 加入复合墨中,通过3D生物打印技术获得双层多细胞支架。从CCK-8检测结果来看,GelMA、GelMA-2MS、GelMA-5MS和GelMA-10MS组的细胞随着时间的推移明显增殖,而GelMA-15MS组的细胞增殖趋势较弱。此外,与其他组相比,GelMA-15MS 组细胞数量在第 14 天最少(图 2E)。因此,考虑到高浓度 MS 纳米颗粒的生物相容性较差,GelMA-15MS 在后续实验中不予考虑。接着,根据曲线0到10%应变的斜率计算弹性模量,结果表明随着MS纳米颗粒含量的增加,支架的弹性模量显著提高。然后,通过 GelMA-MS 的扫描电镜图像观察到,MS 纳米粒子的加入并没有破坏 GelMA 水凝胶的多孔结构(图 S2C)。此外,通过观察活/死图像,BMSCs 和 TSPCs 在 21 天的培养过程中都保持了较高的活力(图 2F)。共聚焦激光扫描显微镜(CLSM)图像显示,在培养过程中,BMSCs(红色荧光)位于下层,TSPCs(绿色荧光)位于上层(图2G),表明多细胞支架具有类似于肌腱骨的仿生结构,并能在14天内保持结构稳定。此外,根据离子释放曲线,Mn 和 Si 离子逐渐释放到培养基中,且释放的 Mn 和 Si 离子的浓度随着 MS 浓度的增加而增加。因此,这些结果证明:本研究成功构建了具有结构稳定性、生物相容性和生物活性离子释放特性的MS纳米颗粒多细胞支架。

图2 MS 纳米颗粒、含有MS 纳米颗粒的生物墨水以及基于 MS 纳米颗粒的多细胞支架的表征
【含有 MS 纳米颗粒的多细胞支架的成骨和致韧分化】
为了探索MS纳米颗粒对支架内BMSCs和TSPCs特异性分化的影响,本研究检测了成骨和成韧标记物。首先,分别分析了早期成骨标志物(碱性磷酸酶,ALP)、晚期成骨标志物(矿化结节)和成骨蛋白(OPN),以评估 MS 纳米粒子对支架底层 BMSCs 成骨分化的影响。分别在第 7 天和第 14 天对含有不同浓度 MS 纳米颗粒的支架内的 BMSCs 进行 ALP 染色和相应的定量分析。如图 3A、C和 D所示,GelMA-2MS 和 GelMA-5MS 可增强 BMSCs 在第 7 天和第 14 天的 ALP 活性。与此同时,GelMA-10MS 在第 7 天对 ALP 活性无明显影响,但在第 14 天提高了 ALP 活性。因此,适当浓度的 MS 纳米颗粒,尤其是 GelMA-2MS 和 GelMA-5MS 对提高支架内 BMSCs 的 ALP 活性有更明显的作用。接着,用茜素红 S(ARS)染色法检测矿化结节,并在钙结节溶解后进行半定量分析(图 3B、E 和 F)。与 GelMA 组相比,GelMA-2MS、GelMA-5MS 和 GelMA-10MS 都能在第 14 天促进矿化结核的形成。其中,GelMA-5MS 在第 14 天产生的矿化结核数量最多,但与 GelMA-2MS 没有显著差异。此外,随着培养时间的延长,各组产生的矿化结核的含量都有所增加。值得注意的是,GelMA-5MS 在第 21 天仍保持最高的矿化结核含量。最后,为了进一步检测不同组中成骨标志的表达,对 OPN 蛋白进行了免疫荧光染色。图 3H 显示,含有 MS 纳米颗粒的多细胞支架中 BMSCs 的 OPN 表达水平均高于纯 GelMA 支架。根据半定量统计,GelMA-5MS 的 OPN 蛋白表达量最高(图 3J)。

图3 包裹在多细胞支架中的BMSCs 的成骨分化和 TSPCs 的成韧分化
【多细胞支架在大鼠 RCT 中诱导的免疫调节和组织功能恢复】
为了探索含有 MS 纳米颗粒的多细胞支架在体内的免疫调节和促进肩关节功能恢复的作用,本研究建立了大鼠RCT(图 4A)。首先,探究了 GelMA-cells 和 GelMA-cells-MS 在受损区域诱导的早期宿主免疫反应。术后第 4 天、第 7 天和第 14 天,研究了不同组别对受损区域植入支架产生反应的免疫细胞类型。值得注意的是,免疫荧光染色和半定量分析结果表明,术后 14 天内,围绕支架的巨噬细胞数量最多,而不是其他免疫细胞,包括白细胞(CD18+ 细胞)、T 细胞(CD4+ 细胞)和 B 细胞(CD21+ 细胞)。此外,在 14 天内,巨噬细胞的数量并没有随着时间的推移而明显减少。然后,对 Arg-1(M2 标记)和 CD68 进行免疫荧光染色,以确定支架周围巨噬细胞的表型(图 4B)。定量分析显示,第 4 天时,缺损周围的 M2 表型巨噬细胞在 GelMA-cells 和 GelMA-cells-MS 组中的比例都很低,两组之间没有显著差异。但在术后第 7 天和第 14 天,GelMA-cells-MS 组的 M2 型巨噬细胞(Arg-1+/CD68+ 细胞)数量高于GelMA-cells 组(图 4C)。这些发现证明,GelMA-细胞-MS 成功地促进了巨噬细胞 M2 极化,并在体内创造了抗炎免疫微环境。

图4 基于 MS 纳米颗粒的多细胞支架实现了免疫调节并诱导大鼠 RCT 的功能恢复
【多细胞支架在兔 RCT 中诱导的组织结构恢复】
在获得良好运动功能的鼓舞下,本研究对兔子 RCT 进行了显微计算机断层扫描(micro-CT)和组织学分析,以进一步评估组织修复的精细程度(图 5A)。首先,用微型计算机断层扫描重建了受损的肱骨。图 5B 显示,空白组的皮质骨明显未愈合,而其他组的皮质骨则较为连续。此外,定量分析显示,GelMA-细胞-MS 组的骨体积/总体积(BV/TV)值是所有组中最高的(图 5C),这证实了含有 MS 纳米颗粒的多细胞支架具有令人满意的骨修复能力。然后,本研究进行组织学染色以进一步探讨支架对肌腱-骨界面的再生能力。界面处纤维软骨的再生是判断 RCT 再生的重要标准。因此,采用赛福宁 O-快绿(SO-FG)染色和甲苯胺蓝(TB)染色来研究纤维软骨的再生情况。如图 5D 和 E所示,GelMA-细胞组、GelMA-MS 组和 GelMA-细胞-MS组的红色区域(纤维软骨)明显大于空白组。半定量分析结果表明,GelMA-细胞-MS 组的变色率明显高于其他组。此外,TB 染色也显示了类似的纤维软骨再生趋势(图 5F和G),表明 GelMA 细胞-MS 促进了体内的纤维软骨再生。此外,根据苏木精和伊红(H&E)以及马森染色的结果,GelMA-细胞-MS 组的组织结构更有序,胶原沉积更多(图5H 和 I)。
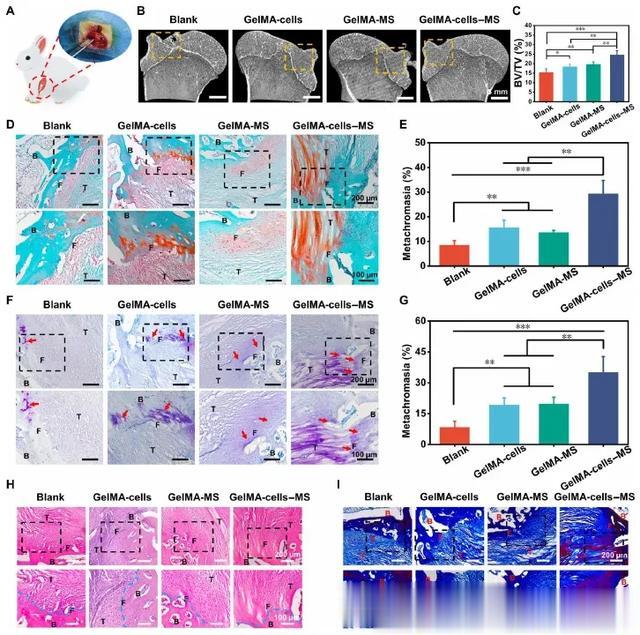
图5 基于 MS 纳米颗粒的多细胞支架促进了兔 RCT 的组织学结构再生
【巨噬细胞耗竭对体内多细胞支架特异性分化的影响】
众所周知,免疫细胞(尤其是巨噬细胞)与组织支架之间的交叉非常重要,有利于调节细胞分化行为和支架介导的组织再生性能。为了阐明巨噬细胞在体内含有 MS 纳米颗粒的多细胞支架特异性分化中的作用,根据之前的报道,本研究通过注射氯膦酸脂质体建立了巨噬细胞缺失的大鼠模型。一组用氯膦酸脂质体处理(Scaffold+Clodronate),另一组用脂质体包裹的磷酸盐缓冲液(PBS)处理作为对照(Scaffold+PBS)(图 6A)。首先,本研究应用 CD68 免疫荧光染色检测支架周围巨噬细胞的数量。如图 6B 和 C所示,Scaffold+PBS组观察到大量巨噬细胞,而Scaffold+Clodronate组几乎没有巨噬细胞,这表明成功创建了巨噬细胞缺失模型。然后,检测多细胞支架分泌的成骨/韧带分化相关细胞因子,以研究无巨噬细胞条件下 BMSCs/TSPCs 的成骨/韧带分化情况。图 6D 表明,Scaffold+PBS中所有成骨分化相关细胞因子(OPN、Runx2、OCN 和 BMP2)的含量都高于Scaffold+Clodronate 中的含量。此外,Scaffold+PBS 组多细胞支架内的 TSPC 也比 Scaffolds+Clodronate 组表达更多的 ASPN、TNMD 和 TNC(图 6E)。这些结果表明,在无巨噬细胞的条件下,MS纳米颗粒诱导多细胞支架中细胞的特异性分化明显降低,说明通过巨噬细胞的免疫调节调节支架中的TSPCs和BMSCs可能是MS纳米颗粒影响肌腱骨再生的一个重要途径。

图6 将基于 MS 纳米粒子的多细胞支架皮下植入巨噬细胞耗竭的大鼠体内,评估其双向活性
【多细胞支架的免疫调节作用和机制】
为了进一步探究 MS 纳米颗粒对巨噬细胞免疫反应的影响,以调控巨噬细胞的特异性分化,本研究采用transwell 系统将 RAW 264.7 细胞与多细胞支架共培养。如图 7A 所示,多细胞支架在上腔培养,巨噬细胞在下腔培养 7 天。所有支架被分为四组,分别为 GelMA-Co(无巨噬细胞和 MS 纳米颗粒的多细胞支架)、GelMA-Co-5MS(无巨噬细胞的多细胞支架)、GelMA-Co+RAW(无 MS 纳米颗粒的多细胞支架)和 GelMA-Co-5MS+RAW(有 MS 纳米颗粒和巨噬细胞的多细胞支架)。考虑到仅含有 MS 纳米粒子的 GelMA 支架无法揭示 MS 纳米粒子在3D多细胞环境中的作用,因此未将含有 MS 纳米粒子的 GelMA 支架作为对照。首先,应用实时定量聚合酶链反应(RT-qPCR)研究巨噬细胞对多细胞支架中 TSPCs 和 BMSCs 特异性分化的影响。图 7B 显示,GelMA-Co 和 GelMA-Co+RAW 在成骨分化相关基因(OPN、OCN、Runx2 和 BSP)的表达上没有显著差异。虽然与 GelMA-Co 相比,GelMA-Co-5MS 能轻微提高 OCN 和 Runx2 的表达,但与 GelMA-Co 和 GelMA-Co-5MS 相比,GelMA-Co-5MS+RAW 能大幅上调 OPN、Runx2 和 BSP 的表达。同时,与 GelMA-Co+RAW 相比,GelMA-Co-5MS+RAW 能上调 BMSCs 中 OPN、OCN 和 Runx2 的表达。此外,GelMA-Co+RAW 组 TSPCs 中 TNC、DCN 和 BGN 的表达与 GelMA-Co 组无显著差异(图 7C)。GelMA-Co-5MS+RAW中TSPCs的TNC和BGN表达量高于其他支架中的TSPCs。根据上述结果发现,在含有 MS 纳米颗粒的多细胞支架中,与巨噬细胞共培养可增强 BMSCs 的成骨分化和 TSPCs 的成腱分化,而在与巨噬细胞共培养的纯多细胞支架中则没有观察到这种效应。这些结果表明,MS 纳米颗粒可通过调节巨噬细胞刺激 BMSCs 和 TSPCs 的特异性分化。

图7 基于 MS 纳米粒子的多细胞支架的免疫调节机制
2. 总结与展望
总之,本研究通过3D生物打印技术成功研制了一种基于MS纳米颗粒的免疫调节多细胞支架,用于肌腱对骨损伤的修复。首先,利用 MS 纳米颗粒的协同作用和包裹多种细胞的优势,多细胞支架具有良好的成骨分化和成腱分化能力。此外,在多细胞支架与巨噬细胞的共培养体系下,支架内的MS纳米颗粒构建了良好的免疫微环境,增强了多细胞支架的双向分化能力。令人鼓舞的是,将含有MS 纳米颗粒的多细胞支架植入三种动物模型后,在体内实现了免疫调节,并显著增强了肌腱与骨界面的综合再生能力、机械性能恢复能力和运动功能。此外,免疫调节支架的内在机制也得到了很好的揭示。研究发现,锰离子能刺激巨噬细胞分泌 PGE2,促进多细胞支架的特异性分化,诱导肌腱到骨的再生。总之,具有免疫调节和综合再生功能的多细胞支架在软硬组织界面再生方面具有巨大潜力。
了解更多
关注“EngineeringForLife”,了解更多前沿科研资讯~