 《自然》子刊:丹娜—法伯癌症研究所将肠道菌改造成免疫“GPS”,指引NK细胞直达肿瘤核心!使肿瘤缩小率达 60%-90%!
《自然》子刊:丹娜—法伯癌症研究所将肠道菌改造成免疫“GPS”,指引NK细胞直达肿瘤核心!使肿瘤缩小率达 60%-90%!你知道吗,肠道中的微小菌群,可能正成为精准抗癌治疗的关键因素?虽然它们的数量庞大,且藏身于看似无关紧要的肠道内,但这些菌群已经在全球癌症研究中引起了广泛关注。
近期,一项来自丹娜—法伯癌症研究所的前沿研究首次揭示,肠道菌群可以像“GPS”一样,帮助免疫细胞精准锁定肿瘤,显著提升免疫疗法的效果。这一发现标志着肠道菌群在肿瘤治疗中所扮演的角色,远比我们想象的更为重要。
肠道菌群:免疫系统的隐藏盟友
肠道菌群,尽管在显微镜下难以辨别,但它们在我们体内的作用堪比一支组织严密的“导航团队”。这些菌群不仅仅维持着我们的消化功能,更通过复杂的生物信号网络,调控着免疫系统的反应。这项来自哈佛的研究指出,肠道菌群在肿瘤治疗中充当了免疫细胞的“GPS”,帮助它们穿透复杂的肿瘤微环境,直达肿瘤组织的“核心地带”。
事实上,关于肠道菌群在肿瘤免疫疗法中的作用,已有多项研究提供了强有力的证据。2015年,Sivan et al. 在《科学》杂志上发表的研究指出,肠道菌群可通过增强宿主的T细胞活性,提高抗PD-L1治疗的效果 。同年,Vetizou et al. 也在另一项发表在《科学》上的研究中证明,肠道菌群可增强抗CTLA-4免疫检查点抑制剂的抗肿瘤活性 。这些研究为肠道菌群在调节免疫反应方面的作用奠定了坚实的基础,并为进一步探索肠道菌群与免疫疗法的关系提供了重要的科学依据。

肠道菌群增强了CAR NK细胞抗肿瘤反应
精准导航:肠道菌群如何“指路”免疫细胞
那么,肠道菌群究竟是如何在肿瘤治疗中帮助免疫细胞呢?丹娜—法伯癌症研究所团队最新发表在《自然生物技术》上的文章中,通过一系列实验发现,肠道菌群可以通过调节代谢产物和免疫因子的方式,重新激活耗竭的免疫细胞,并改善它们在肿瘤微环境中的渗透能力。就像是用新的燃料为一辆快要停滞的汽车重新加油,使其重新恢复动力。
研究人员通过基因工程技术,设计了一种能够定向表达免疫激活因子(如IL-18变体DR18)的工程化大肠杆菌。这些细菌不仅能够在低氧的肿瘤环境中自然定植,还能释放出激活免疫细胞的因子,促使免疫细胞恢复活性,尤其是CD8+T细胞和自然杀伤(NK)细胞。
实验表明,工程化肠道菌群在注射后能够显著增强抗肿瘤免疫反应。例如,在小鼠的结直肠癌和黑色素瘤模型中,肿瘤的缩小率达到了60%-90%。这些研究表明,肠道菌群不仅可以作为“GPS”指引免疫细胞到达肿瘤核心,还能够显著提升免疫疗法的整体效果。

一系列数据表明,将抗诱饵的DR18展示在大肠杆菌表面后,能够在免疫健全的小鼠中产生显著的抗肿瘤作用,抑制了肿瘤的生长并延长了小鼠的存活时间。这表明,这种基因工程细菌有望用于提高肿瘤免疫治疗的效果。
免疫导航与免疫治疗的协同效应不仅如此,肠道菌群的作用还不仅限于单一的免疫细胞激活,它们能够与现有的免疫疗法形成协同效应,进一步增强治疗效果。特别是在免疫检查点抑制剂(如PD-1抑制剂)的联合使用中,研究显示,接受联合治疗的小鼠,其肿瘤治愈率比仅使用免疫检查点抑制剂的小鼠高出30%。
这与2018年发表于《自然医学》的一项研究相一致,该研究由Routy et al. 领衔,指出肠道菌群的组成与癌症患者对免疫检查点抑制剂的反应之间存在显著关联。研究发现,特定菌株(如Akkermansia muciniphila)与更高的抗PD-1治疗反应率密切相关 。这些发现进一步支持了肠道菌群在肿瘤免疫治疗中作为“GPS”的潜力。
肠道菌群如何重塑肿瘤微环境?
肿瘤微环境(TME)是肿瘤得以逃避免疫系统攻击的重要原因之一。它就像一个布满陷阱的迷宫,免疫细胞进入其中后常常被削弱或耗竭,无法发挥应有的作用。然而,肠道菌群能够改变这一局面,它们通过代谢产物和免疫信号的传递,重塑肿瘤微环境,使免疫细胞的功能得到恢复。
研究表明,工程化肠道菌群能够通过释放细胞因子,削弱肿瘤微环境中的免疫抑制机制。这一过程类似于解除了一系列“免疫封锁”,让原本被抑制的免疫细胞重新活跃起来,并直接攻击肿瘤。肠道菌群通过这种方式,帮助免疫系统在肿瘤内部重新获得了“战斗力”,使治疗效果大大提升。
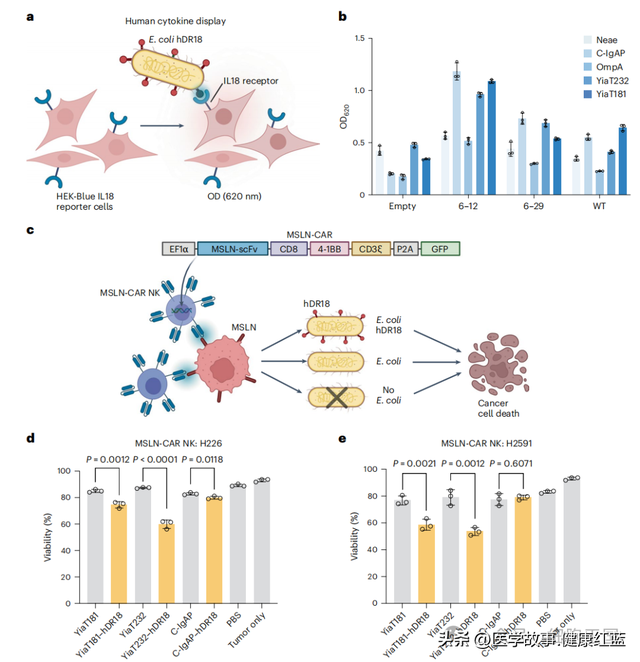
携带hDR18的细菌可以通过激活NK细胞增强其抗肿瘤能力,特别是靶向MSLN的CAR NK细胞的抗肿瘤效应更为显著。这提示了hDR18展示的细菌可作为一种有前景的免疫治疗辅助工具,用于增强CAR NK细胞的抗肿瘤效果。
随着这些前沿研究的进展,肠道菌群作为肿瘤免疫治疗的潜力变得越来越明显。科学家们已经开始探索如何根据患者个体的肠道菌群特征,定制个性化的肿瘤免疫治疗方案。这意味着,未来的癌症治疗不再是千篇一律,而是根据每位患者的独特微生物组成进行调整。
这种个性化治疗方案,类似于为每位患者量身定制的精准导航系统。通过分析肠道菌群的种类和数量,科学家可以确定哪些菌群有助于增强免疫反应,哪些菌群可能会削弱治疗效果。通过调节肠道菌群的组成,未来的免疫疗法将更加精准、高效,且副作用更小。
肠道菌群的革命性应用
总的来说,肠道菌群作为肿瘤免疫治疗中的“GPS”,为我们提供了一条全新的抗癌路径。通过精准引导免疫细胞并提升其杀伤能力,肠道菌群显著增强了免疫疗法的效果。越来越多的研究表明,肠道菌群与免疫治疗效果存在紧密联系,正如前述研究所示,这一领域已成为肿瘤治疗中的一个关键突破口。未来,随着个性化治疗的进一步发展,肠道菌群有望成为癌症治疗中的重要组成部分,为全球数百万癌症患者带来新的希望。
这场与癌症的战斗,不仅仅依靠强大的药物和先进的设备,肠道菌群研究的不断深入,正在逐步改变我们对肿瘤治疗的认知与策略。
References
[1] Sivan, A., Corrales, L., Hubert, N., Williams, J. B., Aquino-Michaels, K., Earley, Z. M., ... & Gajewski, T. F. (2015). Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy. Science, 350(6264), 1084-1089.
[2] Vetizou, M., Pitt, J. M., Daillere, R., Lepage, P., Waldschmitt, N., Flament, C., ... & Zitvogel, L. (2015). Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota. Science, 350(6264), 1079-1084.
[3] Routy, B., Le Chatelier, E., Derosa, L., Duong, C. P., Alou, M. T., Daillère, R., ... & Zitvogel, L. (2018). Gut microbiome influences efficacy of PD-1–based immunotherapy against epithelial tumors. Nature Medicine, 24(2), 144-153.
[4] Tanoue, T., Morita, S., Plichta, D. R., Skelly, A. N., Suda, W., Sugiura, Y., ... & Honda, K. (2019). A defined commensal consortium elicits CD8 T cells and anti-cancer immunity. Nature, 565(7741), 600-605.