
引言
非转化细胞中异常癌基因激活导致产生一种不可逆的细胞周期停滞状态,称为癌基因诱导的衰老(oncogene-induced senescence,OIS),除了癌基因过度活跃外,衰老还可以由多种其他应激引发,包括端粒缩短、DNA损伤以及氧化应激等。细胞衰老对人类健康和疾病的广泛影响使得全面了解驱动这一关键过程的分子机制尤为重要。
尽管已经鉴定出许多参与衰老过程的蛋白质编码基因,但非编码RNA如小核仁RNA(small nucleolar RNAs,snoRNAs)在细胞衰老中的具体作用仍不明朗。snoRNAs通过独特的核糖核蛋白复合物指导RNA化学修饰,分为H/ACA和C/D box snoRNPs两组(RNP:ribonucleoprotein),分别参与RNA的假尿苷化和甲基化。除此之外,snoRNAs还具备调节mRNA剪接的功能,snoRNA中的SNORA24在衰老与肿瘤中的作用研究,证明了它与翻译保真度及Ras通路存在复杂联系,其他snoRNA还有待进一步发掘。
近日,来自美国德克萨斯大学西南医学中心的Joshua T. Mendell研究小组在Cell杂志上发表题为A non-canonical role for a small nucleolar RNA in ribosome biogenesis and senescence的研究论文,这篇文章发现SNORA13作为一种高度保守的H/ACA box snoRNA对于衰老至关重要,SNORA13的缺失加速了60S核糖体亚基的生物合成,从而减轻了核仁应激和随之而来的p53激活,SNORA13通过与RPL23的直接相互作用调节60S亚基的组装速率,促进p53介导的细胞衰老。这项发现揭示了H/ACA box snoRNA调节核糖体生物合成和p53途径的新方式,对细胞衰老研究具有重要的意义。
 作者利用CRISPRi技术对癌基因诱导的细胞衰老(OIS)过程中关键的非编码RNA进行了全基因组筛选,并成功鉴定出重要候选EPB41L4A-AS1,在OIS过程中扮演关键角色。EPB41L4A-AS1是一种高度保守的H/ACA box snoRNA SNORA13的宿主转录本,在三苯氧胺诱导的HRASG12V转基因成纤维细胞模型中敲低EPB41L4A-AS1显著影响细胞在衰老诱导条件下的反应,阻止细胞进入衰老状态并维持增殖能力。这些结果表明EPB41L4A-AS1及其编码的snoRNA在OIS调控过程中是必需的。CRISPR特异性敲除SNORA13,同时保留其余转录本完整性,细胞在致癌应激下无法进入衰老状态。进一步回补实验发现只有含SNORA13的构建体能够在诱导HRASG12V后拯救细胞衰老。此外,在原代人成纤维细胞中的实验也表明SNORA13的缺失会损害多种衰老途径,表明SNORA13这一snoRNA在多种衰老形式中都扮演关键角色。SNORA13作为snoRNAs的H/ACA box 家族成员,其重要功能在于指导18S rRNA上第1248位核苷酸的假尿嘧啶化。SNORA13敲除并未引起翻译效率的显著变化,说明它主要不是通过翻译调控衰老。在SNORA13敲除的细胞中,无论是否激活致癌基因HRASG12V,游离60S亚基及80S单体核糖体的稳态丰度均显著增加。通过标记大核糖体亚基RPL28蛋白的方法,进一步证实了SNORA13缺失加速了60S亚基及80S亚基的生物合成速率,新合成的RPL28蛋白从核仁到细胞质的转运增加,支持了其对60S亚基生物合成的负调控作用。GSEA分析发现SNORA13缺失导致p53通路活性下降,p53靶基因如CDKN1A表达减少,且在致癌应激诱导后,大部分蛋白质定位于细胞质中,与野生型细胞在这些条件下发生的p53在核中的大量积累形成鲜明对比。这与MDM2在SNORA13缺失细胞中保持部分活性有关,阻碍了p53的核积累和靶基因转录。进一步机制探索发现,SNORA13敲除后游离RPs对MDM2的抑制作用减弱,MDM2得以持续抑制p53,进而抑制了细胞衰老程序。因此,SNORA13通过核仁应激反应途径调节p53活性(图1)。SNORA13的功能一是指导18S rRNA的假尿嘧啶化,这是它的常见功能;二是通过新机制调控60S核糖体亚基的生物合成和细胞衰老,这种机制独立于其对18S rRNA的修饰作用。即使SNORA13的突变体失去了指导假尿嘧啶化的能力,它们仍能在敲除细胞中减缓衰老并调节60S核糖体亚基的丰度至野生型水平。通过反义寡核苷酸纯化及质谱分析、紫外线交联和RNA免疫沉淀等方法,发现SNORA13直接与核糖体蛋白大核糖体亚基组分RPL23相互作用,这种相互作用在核糖体亚基外发生,SNORA13能够竞争性地抑制RPL23与28S rRNA的结合,减缓60S亚基的生物合成速率。因此,SNORA13通过负调控核糖体生物合成,在致癌应激条件下激活核仁应激反应。
作者利用CRISPRi技术对癌基因诱导的细胞衰老(OIS)过程中关键的非编码RNA进行了全基因组筛选,并成功鉴定出重要候选EPB41L4A-AS1,在OIS过程中扮演关键角色。EPB41L4A-AS1是一种高度保守的H/ACA box snoRNA SNORA13的宿主转录本,在三苯氧胺诱导的HRASG12V转基因成纤维细胞模型中敲低EPB41L4A-AS1显著影响细胞在衰老诱导条件下的反应,阻止细胞进入衰老状态并维持增殖能力。这些结果表明EPB41L4A-AS1及其编码的snoRNA在OIS调控过程中是必需的。CRISPR特异性敲除SNORA13,同时保留其余转录本完整性,细胞在致癌应激下无法进入衰老状态。进一步回补实验发现只有含SNORA13的构建体能够在诱导HRASG12V后拯救细胞衰老。此外,在原代人成纤维细胞中的实验也表明SNORA13的缺失会损害多种衰老途径,表明SNORA13这一snoRNA在多种衰老形式中都扮演关键角色。SNORA13作为snoRNAs的H/ACA box 家族成员,其重要功能在于指导18S rRNA上第1248位核苷酸的假尿嘧啶化。SNORA13敲除并未引起翻译效率的显著变化,说明它主要不是通过翻译调控衰老。在SNORA13敲除的细胞中,无论是否激活致癌基因HRASG12V,游离60S亚基及80S单体核糖体的稳态丰度均显著增加。通过标记大核糖体亚基RPL28蛋白的方法,进一步证实了SNORA13缺失加速了60S亚基及80S亚基的生物合成速率,新合成的RPL28蛋白从核仁到细胞质的转运增加,支持了其对60S亚基生物合成的负调控作用。GSEA分析发现SNORA13缺失导致p53通路活性下降,p53靶基因如CDKN1A表达减少,且在致癌应激诱导后,大部分蛋白质定位于细胞质中,与野生型细胞在这些条件下发生的p53在核中的大量积累形成鲜明对比。这与MDM2在SNORA13缺失细胞中保持部分活性有关,阻碍了p53的核积累和靶基因转录。进一步机制探索发现,SNORA13敲除后游离RPs对MDM2的抑制作用减弱,MDM2得以持续抑制p53,进而抑制了细胞衰老程序。因此,SNORA13通过核仁应激反应途径调节p53活性(图1)。SNORA13的功能一是指导18S rRNA的假尿嘧啶化,这是它的常见功能;二是通过新机制调控60S核糖体亚基的生物合成和细胞衰老,这种机制独立于其对18S rRNA的修饰作用。即使SNORA13的突变体失去了指导假尿嘧啶化的能力,它们仍能在敲除细胞中减缓衰老并调节60S核糖体亚基的丰度至野生型水平。通过反义寡核苷酸纯化及质谱分析、紫外线交联和RNA免疫沉淀等方法,发现SNORA13直接与核糖体蛋白大核糖体亚基组分RPL23相互作用,这种相互作用在核糖体亚基外发生,SNORA13能够竞争性地抑制RPL23与28S rRNA的结合,减缓60S亚基的生物合成速率。因此,SNORA13通过负调控核糖体生物合成,在致癌应激条件下激活核仁应激反应。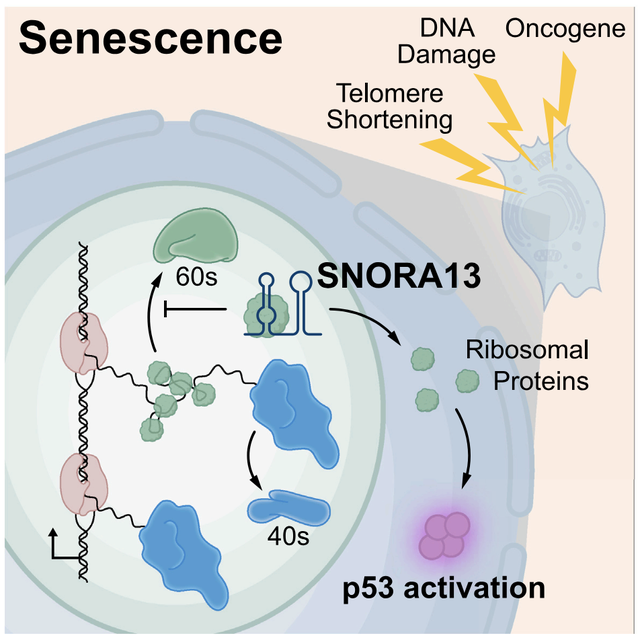
参考文献
https://doi.org/10.1016/j.cell.2024.06.019责编|探索君
排版|探索君
文章来源|“BioArt”
End
往期精选
围观
一文读透细胞死亡(Cell Death) | 24年Cell重磅综述(长文收藏版)热文
Cell | 是什么决定了细胞的大小?热文
Nature | 2024年值得关注的七项技术热文
Nature | 自身免疫性疾病能被治愈吗?科学家们终于看到了希望热文
CRISPR技术进化史 | 24年Cell综述