呼吸泵功能的评估是呼吸康复临床实践和研究的重要组成部分。
近些年来,利用呼吸力学、呼吸肌神经生理学(肌电图、脑电图、经颅磁刺激)和呼吸肌成像(超声、光电体积描记术、结构光体积描记术)领域取得了关键进展,不同方法的有效性,精度,可重复性,预后价值和对干预的反应性都有所不同。本文就呼吸肌功能的评估方法做简单的介绍。
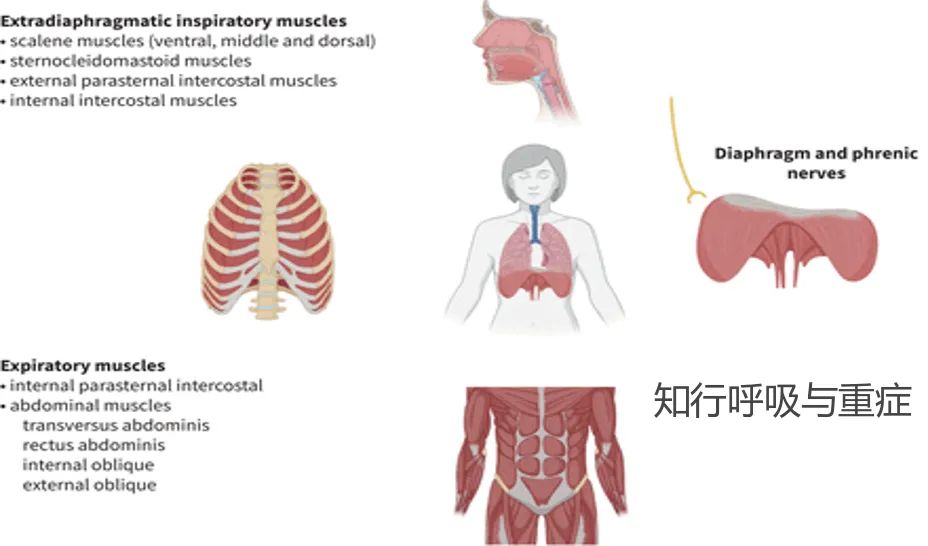
·一、呼吸肌功能评估 ·
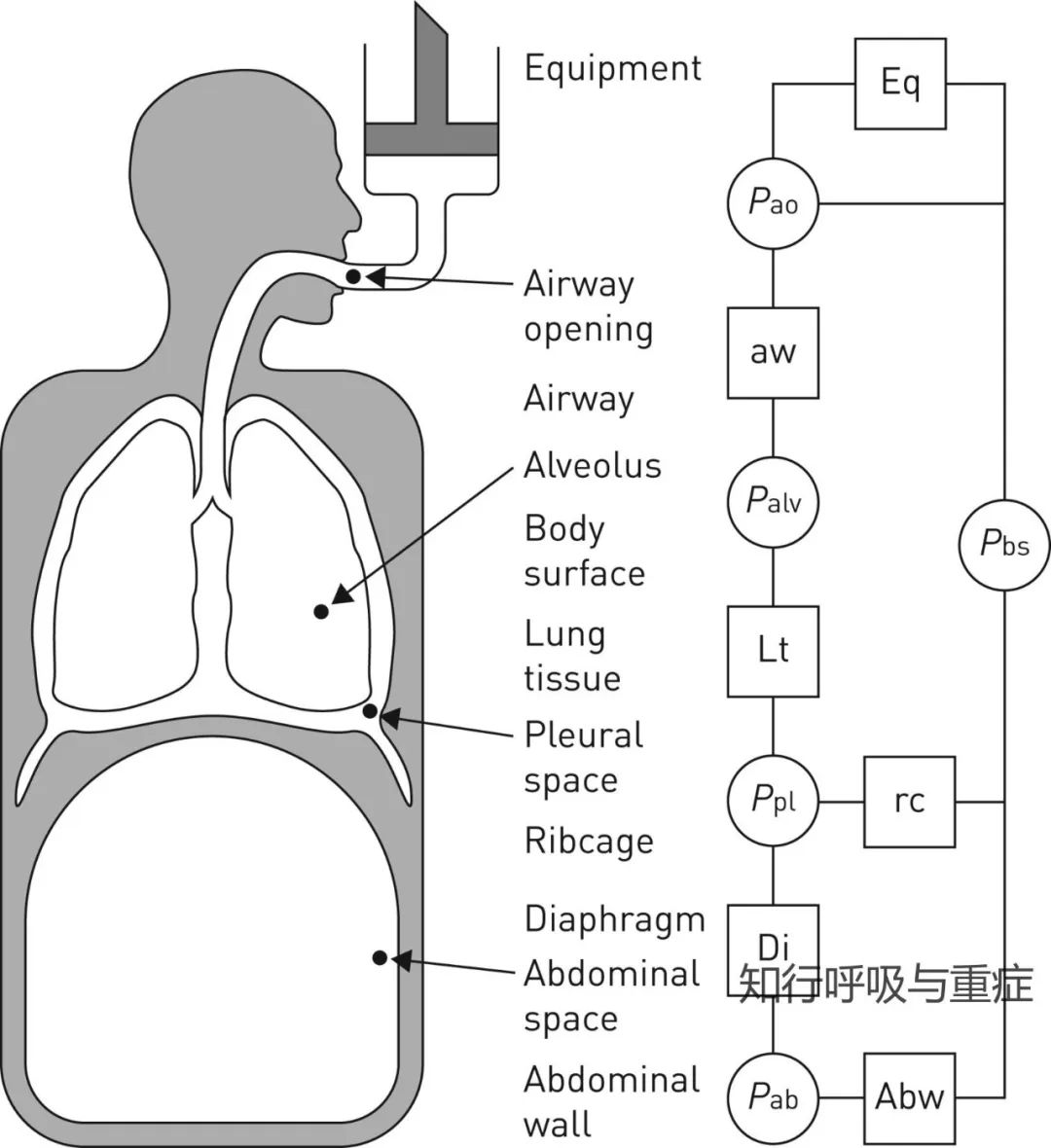
呼吸肌收缩时可出现压力变化和肺容积变化。因此在临床上可以通过压力的变化或容积的变化来评估呼吸肌功能,在评估需要考虑以下几个关键点:
· 1.1 自主呼吸肌力测试·
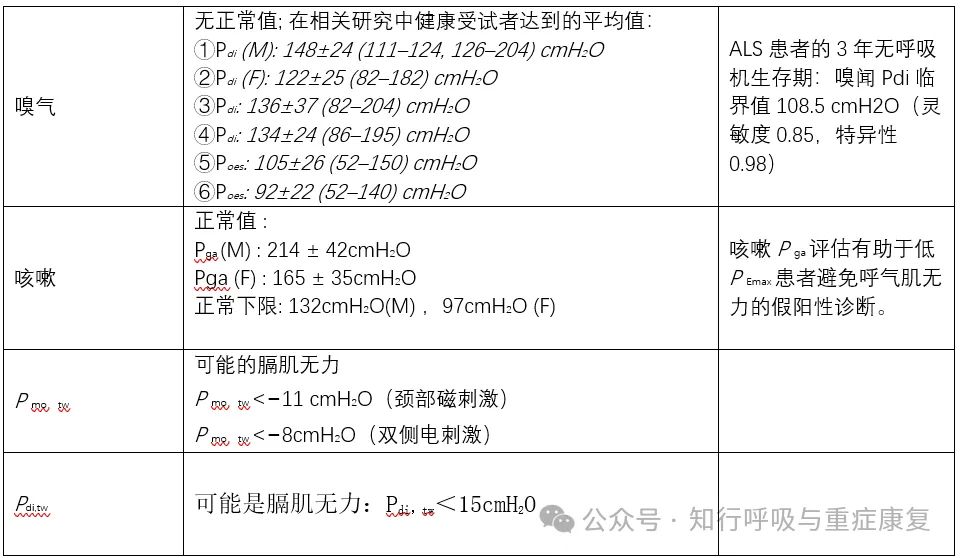
1)气道闭合压(P0.1):是在功能残气位阻断气道后100ms内测量的气道压力。其在气道开口处测量,是评估呼吸中枢驱动的有效指标。P0.1有三个决定因素:①呼吸驱动;②神经信号传导到吸气肌;③吸气肌的收缩功能。因此,P0.1的偏高表明呼吸驱动强,而偏低的影响因素众多,不一定代表驱动降低。当存在内源性呼气正压(IPEEP)的情况下,P0.1可能会低估呼吸中枢的驱动。
在健康受试者静息状态中,P0.1介于0.5和1.5cmH2O之间。
在稳定的慢性阻塞性肺疾病(COPD)患者中,P0.1在2.5和5cmH2O之间。
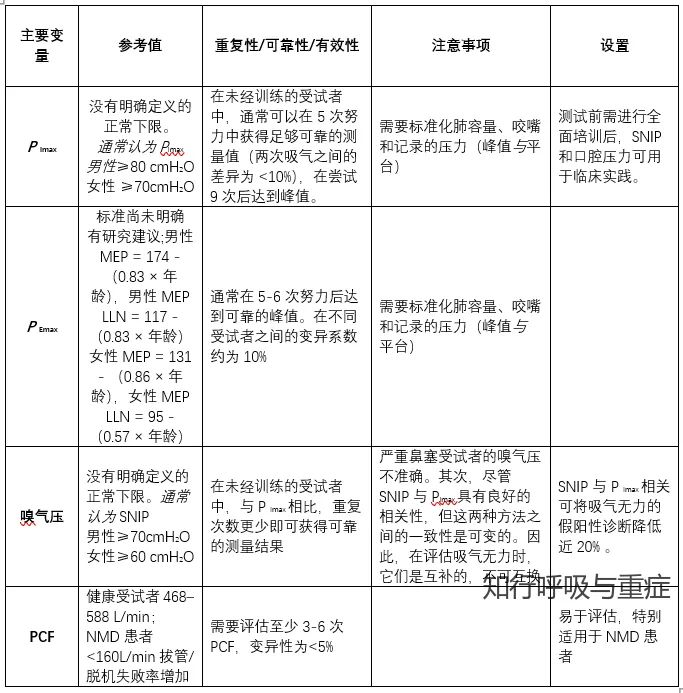
2)经口最大静态吸气(PImax)压与经口最大呼气(PEmax)压

①在压力测试期间,需要受试者充分配合,②其中PImax通常在RV处测量,而PEmax在TLC处测量,③理想情况下,吸气和呼气压力必须保持至少1.5秒。④当3个吸气动作或呼气动作的变化小于10%的情况下记录最大值。⑤在既往普遍以男性≥80cmH2O,女性≥70cmH2O作为排除吸气肌无力的标准。
在西班牙一项多中心的研究中,呼吸肌无力的临界点是女性PImax为62cmH2O,PEmax为81cmH2O;男性PImax为83cmH2O,PEmax为109cmH2O
3)最大嗅气压
SNIP通常在坐位下进行测试,为了避免漏气,一个鼻孔完全被压力传感器(塞子)封闭,而另一个鼻孔保持开放。通常两个鼻孔都要进行测试,1-3次SNIP动作,选择产生更高值的鼻孔进一步测试。SNIP的大小是几个吸气肌的协调作用而产生的,并不是特定于膈肌收缩。
①测试时在功能残气量(FRC)开始,受试者被指导进行短暂且快速的嗅气,嗅闻的持续时间应小于500毫秒。通常,10次试验足以达到SNIP的最高值。
②SNIP已在健康个体和COPD患者中得到验证,对>2 岁的儿童也非常有用。
③对于没有严重鼻塞的健康受试者,精度高。即使在 COPD 中也有很好的可重复性。
4)咳嗽峰值流速
PCF的测量通常在坐位下进行。口鼻面罩/咬嘴连接到呼吸记录仪或峰值流量计。
①受试者在完全吸入后进行用力咳嗽。
②执行3-6 次操作(<5%变异率)和记录最大PCF。

· 1.2 食管和胃压力·
在非侵入性测量由于解剖、功能或配合原因无法执行时,如上呼吸道阻塞(如腺样体肥大、鼻炎、息肉)、下呼吸道阻塞或声带功能受损时无法测得准确的MIP、SNIP、MEP或PCF。可在患者在自主动作(如嗅气和咳嗽)期间记录Poes和Pga信号。从而计算跨膈压(Pdi = Pga - Poes)。
在ICU中,使用食管和胃气囊可以在用力吸气期间记录插管患者最大食管压力(Poes,max)和最大跨膈压(Pdi,max)。Poes,max可以用来评估整体吸气肌力量,而Pdi,max可以用来评估膈肌力量。

在测量时,对于嗅气和咳嗽动作,需要鼓励患者尽力做3-10次动作以获得最佳表现。
· 1.3 呼吸肌相关的呼吸力学·
肺功能检查是无创且可及性高的测量方法,直立位和仰卧位肺活量(VC)取决于吸气肌和呼气肌的收缩,因此有助于评估呼吸肌功能,尤其是膈肌功能。
①单侧膈肌无力通常会出现VC的少量降低,约为预测值的75%,仰卧位进一步减少10-20%,而FRC和TLC通常相对正常。
②在重度双侧膈肌无力中,VC通常只有预测值的50%,仰卧位时可进一步降低30%或者更多。
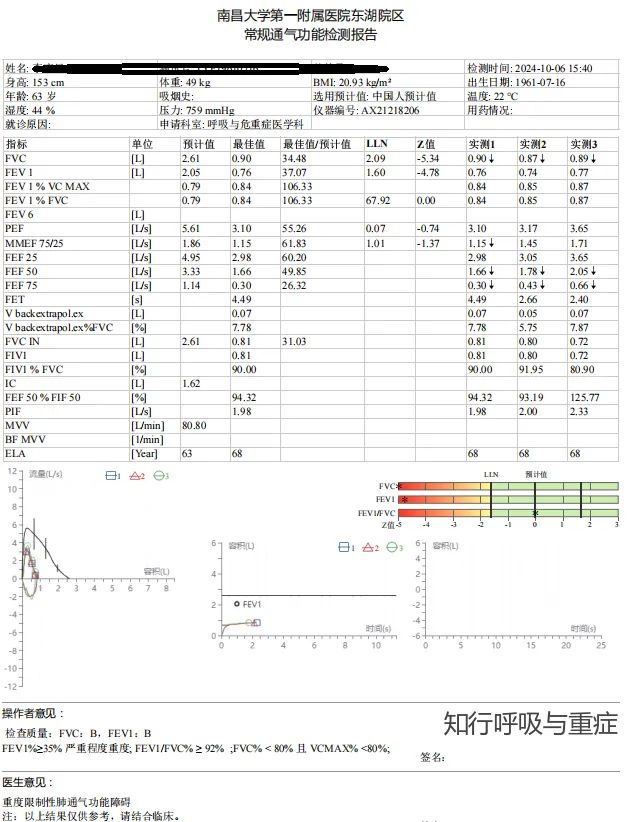
③TLC也可以降低(轻度无力时为预测值的 70-79%,中度至重度无力时可达预测值的 30-50%),而RV可升高。
· 1.4 肌电图·
肌电图(EMG)是一种量化肌肉电活动的技术,在研究和临床实践中用于评估呼吸肌功能,包括估计呼吸驱动输出量、负荷呼吸期间的神经力学耦合、结合通气测量时肌肉收缩的效率以及诊断肌病和神经病。
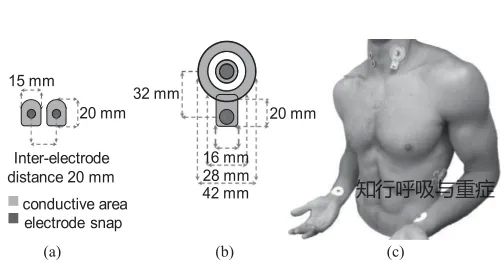
①呼吸EMG可以通过表面电极、经鼻子插入的食管电极以及肌内金属丝或针电极来记录。
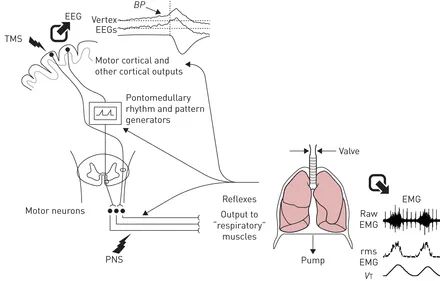
呼吸肌电图测量通常会受到心电图的干扰,此外,表面电极的记录,会受到电磁、邻近肌肉收缩以及肺体积或姿势变化的干扰。
①因为非侵入性,表面肋间肌电图已作为呼吸运动输出、呼吸负荷能力平衡以及潜在肺部疾病严重程度的替代指标。
②对于诱发反应,使用电或磁刺激可以获得膈神经传导时间的正常值。
简而言之,膈肌肌电图是呼吸努力的替代指标。可用于区分中枢性和阻塞性睡眠呼吸暂停事件,评估运动期间的劳力性呼吸困难,当与室性心动过速记录结合时,可用于评估上呼吸道阻力。
· 1.5 超声技术·
使用超声评估膈肌的常用指标为:
1) 呼气末膈肌厚度 (Tdi) 的静态测量;
2)膈肌增厚率 (吸气厚度/呼气厚度) 或增厚分数 ((吸气厚度 - 呼气厚度)/呼气末厚度);
3) 膈肌移动度。
使用超声评估腹肌功能的常用指标为腹直肌、腹外斜肌、腹内斜肌、腹横肌厚度。
在本公众号往期内容已有整理,在此不赘述,点击链接阅读原文→第128期 [温故知新]膈肌超声在呼吸康复中的应用;→第148期 机械通气过程中腹肌超声的应用

· 1.6 光电子体积描记术·
光电体积描记术(opelectronic plethyshuography, OEP)是一种可以测量胸壁及其容积的周期变化成熟的技术。
①扫描后从三个不同腔室进行建模:膈肌、肋间肌、胸骨旁肌、斜角肌和颈部肌肉在吸气与呼气时改变肺胸腔 (rcp),膈肌、腹部肌肉在呼气时改变腹腔 (rca) 和腹部 (ab)。总胸壁体积 ( Vcw ) 是这三个腔室(Vrcp、Vrca和Vab)之和。
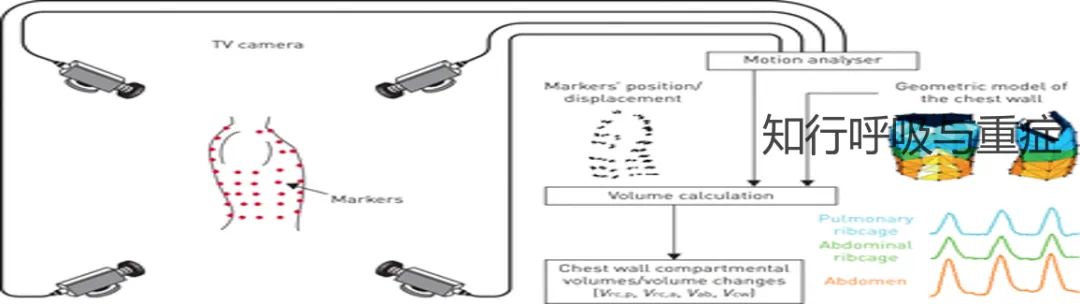
②在疾病状态下,当每个肌肉群单独收缩或协同受损时,三个腔室之间可观察到不同步或完全“矛盾”的运动
③研究发现,COPD患者在递增强度运动期间一直存在动态过度充气,而那些在静息时呼气流量储备更大的患者,在胸壁呼气末容积方面可观察到至少两种明显不同的变化模式:一部分患者显示胸壁呼气末容积进行性显著增加(“早期过度充气”),而另一些则显示仅在更高水平的运动时增加(“晚期过度充气”)
· 二、呼吸肌结构、灌注和代谢评估 ·
目前有几种方法可以评估调节呼吸肌血流、氧气输送的机制、氧化代谢需求及线粒体功能之间的关系,以及氧化应激和炎症的影响。
· 2.1 近红外光谱·
将近红外光谱(NIRS)与光吸收示踪染料吲哚菁绿(ICG)相结合的技术被用于测量肋间肌肉血流量(IMBF)。在2008年,Guenette等人首次量化了健康受试者在休息时的不同最大通气量百分比下的IMBF。结果发现,随着通气量的增加,IMBF与心输出量、WOB和Pdi的增加显著相关。
· 2.2 活检(呼吸肌的特异性)·
呼吸肌的侵入性研究非常有限,通常是因临床原因进行的需要开胸手术(如肺癌和肺减容手术)时进行。
· 2.3 呼吸肌肌纤维类型·
膈肌I型纤维增加,有利于有氧代谢。通气负荷增可影响呼吸肌的结构变化(损伤和再生周期)。
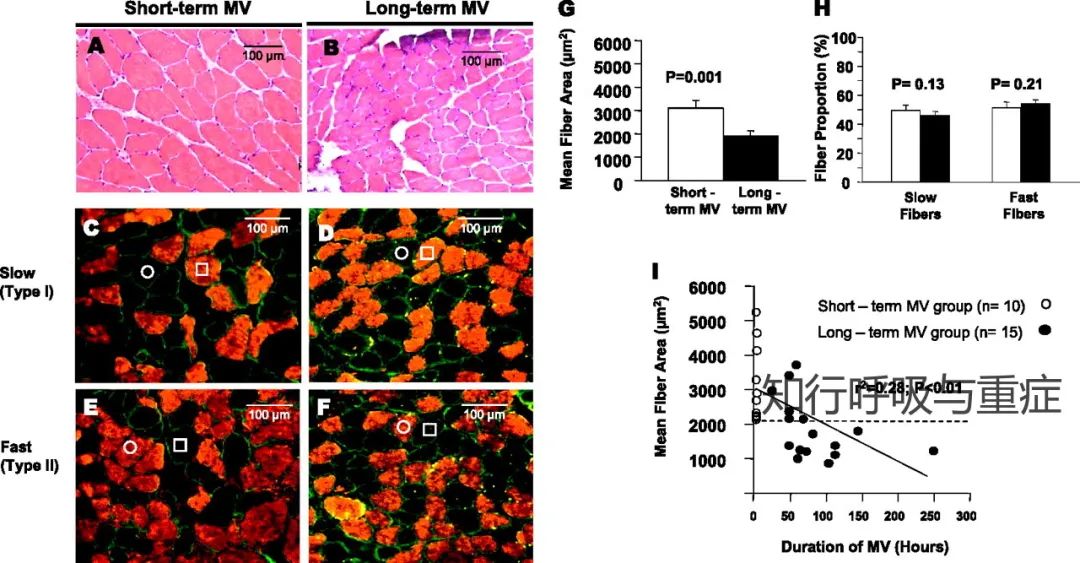
呼吸肌训练增加了I型纤维的大小和比例。在阻塞性睡眠呼吸暂停综合征(OSAS)患者中,肋间肌中I型纤维的比例增加。
· 2.3 呼吸耗氧量·
呼吸耗氧量是呼吸运动所需氧量。在静息状态下,呼吸肌使用1-2%的总氧摄取量(VO2),大约为2.5ml/min,在运动期间,通气和WOB与代谢需求成比例增加。最大运动期间的呼吸氧耗量约为全身最大氧摄取量的10%,在男性的耐力训练呼吸耗氧量>15%。
· 2.4 呼吸肌肉的生物能量学·
在静息状态下,呼吸肌的代谢需求相对较低,但在运动期间,随着通气量的增加,需求显著上升。呼吸肌收缩时消耗的能量大部分来自氧化代谢途径,但在高强度收缩时,也会动用到无氧代谢途径。呼吸肌的耐力和效率受到其氧化代谢能力的限制。在慢性阻塞性肺疾病(COPD)和其他呼吸肌肉疾病中,呼吸肌的氧化代谢能力可能受损,导致肌肉疲劳和功能障碍。
· 2.5 呼吸肌肉的线粒体功能·
线粒体功能在呼吸肌肉的健康和疾病中起着关键作用。线粒体是细胞内的能量工厂,负责产生三磷酸腺苷(ATP),其是肌肉收缩的主要能量来源。在COPD等病理状态下,呼吸肌肉的线粒体功能受到损害,导致能量产生不足,进而引起肌肉疲劳。
· 2.6 呼吸肌肉的血流灌注·
呼吸肌肉的血流灌注对其功能至关重要。在运动或病理状态下,呼吸肌肉的代谢需求增加,需要更多的血液供应以满足这些需求。血流灌注不足可能导致肌肉缺氧和代谢废物的积累,最终导致肌肉疲劳和功能障碍。
· 2.7 呼吸肌肉的炎症和氧化应激·
炎症和氧化应激在呼吸肌肉疾病中起着重要作用。在COPD等病理状态下,呼吸肌肉可能遭受炎症细胞因子和活性氧物质的攻击,导致肌肉损伤和功能障碍。氧化应激还可能导致呼吸肌肉的蛋白质和脂质氧化,进一步损害肌肉功能。
· 参考文献 ·
[1]Laveneziana, Pierantonio et al. “ERS statement on respiratory muscle testing at rest and during exercise.” The European respiratory journal vol. 53,6 1801214. 13 Jun.2019,doi:10.1183/13993003.01214-2018
[2]Evans, John A, and William A Whitelaw. “The assessment of maximal respiratory mouth pressures in adults.” Respiratory care vol. 54,10 (2009): 1348-59.
[3]Lista-Paz, Ana et al. “Maximal Respiratory Pressure Reference Equations in Healthy Adults and Cut-off Points for Defining Respiratory Muscle Weakness.” Archivos de bronconeumologia vol. 59,12 (2023): 813-820. doi:10.1016/j.arbres.2023.08.016
[4]Larribaut, J et al. “Methodology and reliability of respiratory muscle assessment.” Respiratory physiology & neurobiology vol. 273 (2020): 103321. doi:10.1016/j.resp.2019.103321
[5]Tuinman, Pieter R et al. “Respiratory muscle ultrasonography: methodology, basic and advanced principles and clinical applications in ICU and ED patients-a narrative review.” Intensive care medicine vol. 46,4 (2020): 594-605. doi:10.1007/s00134-019-05892-8