
急性髓性白血病(AML)是一种恶性肿瘤,在骨髓、血液和其他组织中表现为异常增殖的造血祖细胞和干细胞浸润。细胞遗传学和分子异质性导致AML的难治性和复发。治疗中的一个关键障碍是微小残留病(MRD),其特征是白血病起始干细胞(LICs)的存在,在某种程度上是疾病复发的关键。这些细胞在自我更新、增殖和分化方面与正常的人造血干细胞相似。因此,随着癌症干细胞成分不断得到更好的定义,靶向LICs的替代疗法为治疗AML和其他恶性肿瘤开辟了新的途径。

GPR44在多种细胞类型上表达,但主要表达于Th2效应细胞,关于GPR44的文献大多涉及其在自身免疫性疾病和2型免疫中的作用,而对其在血液恶性肿瘤中的作用的研究明显缺乏。
在本研究中,作者发现激活GPR44能够介导内源性的抗白血病作用。即在小鼠AML模型和患者源性AML细胞的LICs中添加硒后产生环戊烯酮前列腺素(CyPGs),CyPGs激活GPR44可抑制KRAS介导的MAPK和PI3K/AKT/mTOR信号通路,促进AML细胞凋亡。这些研究强调了GPR44在白血病中的重要治疗作用,并在AML中为硒和CyPGs的化学预防特性提供了机制基础。
研究结果硒补充可改善急性髓性白血病的预后
作者首先将CD45.1 WT AML细胞移植到预先食用了4周的食物(Se-A或Se-S)的cd45.2受体小鼠,构建继发性AML小鼠。3周后处死小鼠,取血液、骨髓、脾脏标本。可以发现Se-S可以显著减少骨髓和脾脏中LIC负荷,并延长AML小鼠的存活时间。随后比较了不同形式的膳食硒(包括Na2SeO3和SeMet)对AML小鼠的影响,可以发现膳食硒后可以降低白细胞的水平。同时还能缓解脾脏肿大和肝脏肿大。
作者的研究结果证实了在膳食中通过对硒的补充能明显抑制AML, 并且Na2SeO3在AML中的预防优势优于SeMet。
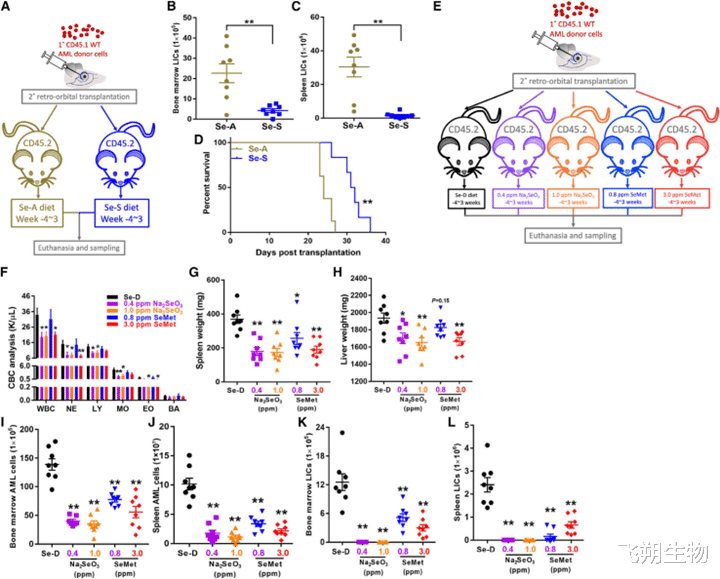
Figure 1. Se supplementation improves the outcome of AML
硒补充诱导AML内源性CyPGs的产生
随后作者检测AML小鼠血清15d-PGJ2(前列腺素J2)的含量并评估了环氧化酶-1 (COX-1)和造血PGD合成酶(H-PGDS)的表达。结果显示含硒膳食能显著增强前列腺素J2合成的相关蛋白COX-1和H-PGDS表达,促进PGJ2含量升高。
为了进一步研究H-PGDS的潜在作用,作者使用H-PGDS抑制剂HQL79治疗Se-S AML小鼠,以阻断内源性CyPGs的产生,结果显示在Se-S小鼠的骨髓和脾脏中发现HQL79治疗增加了肿瘤负荷,增加了LICs含量。总之,这些结果表明硒补充通过增加H-PGDS表达增强内源性CyPGs来减轻AML。

Figure 2. Se supplement induces endogenous production of CyPGs in AML
激活GPR44可降低白血病的严重程度
接下来,作者检测了不同形式的外源性CyPGs是否可以治疗Se-A小鼠的AML。结果显示,用CyPGs (DK-PGD2、15d-PGJ2、 Δ12-PGJ2和D12-PGJ3)治疗后。小鼠显示CBC减少并减缓了脾肿大。并且除DK-PGD2外,其余化合物均能诱导人急性骨髓白血病细胞MOLM13死亡,呈剂量和时间依赖性。同时,在MOLM13细胞中,转录本和蛋白水平也均检测到GPR44的表达,并且其胞内形式明显增加。强调了CyPGs在AML中对GPR44的细胞膜定位的重要性。
随后作者还验证了临床相关性,用DK-PGD2或15d-PGJ2治疗患者源性AML细胞。12例AML患者样本中有9例对DK-PGD2有反应,细胞凋亡增强。经检测发现对DK-PGD2治疗敏感的患者样本显示GPR44的表达更高,比难治样本增加了4倍以上,进一步突出了GPR44在AML中的关键作用。以上结果表明增加内源性CyPGs或使用药理学剂量的外源性CyPGs有效治疗髓性白血病。

Figure 3. GPR44 activation decreases the severity of leukemia
AML细胞缺失GPR44会导致侵袭性疾病
之前表明GPR44在CyPGs诱导AML细胞凋亡起着至关重要的作用。因此作者验证了GPR44缺失对AML细胞的作用。和对照相比,用Se-S饮食移植GPR44-/- AML细胞的WT受体白细胞增多和脾肿大增加。在移植了GPR44 - / -AML细胞的小鼠中,骨髓和脾脏的Lin-AML细胞总数和LICs比移植了WT AML的小鼠增加了2倍以上。GPR44的缺失导致AML细胞的集落形成能力增加约10倍。提示GPR44高表达可能是CyPG治疗的靶标,而不是预后因素。
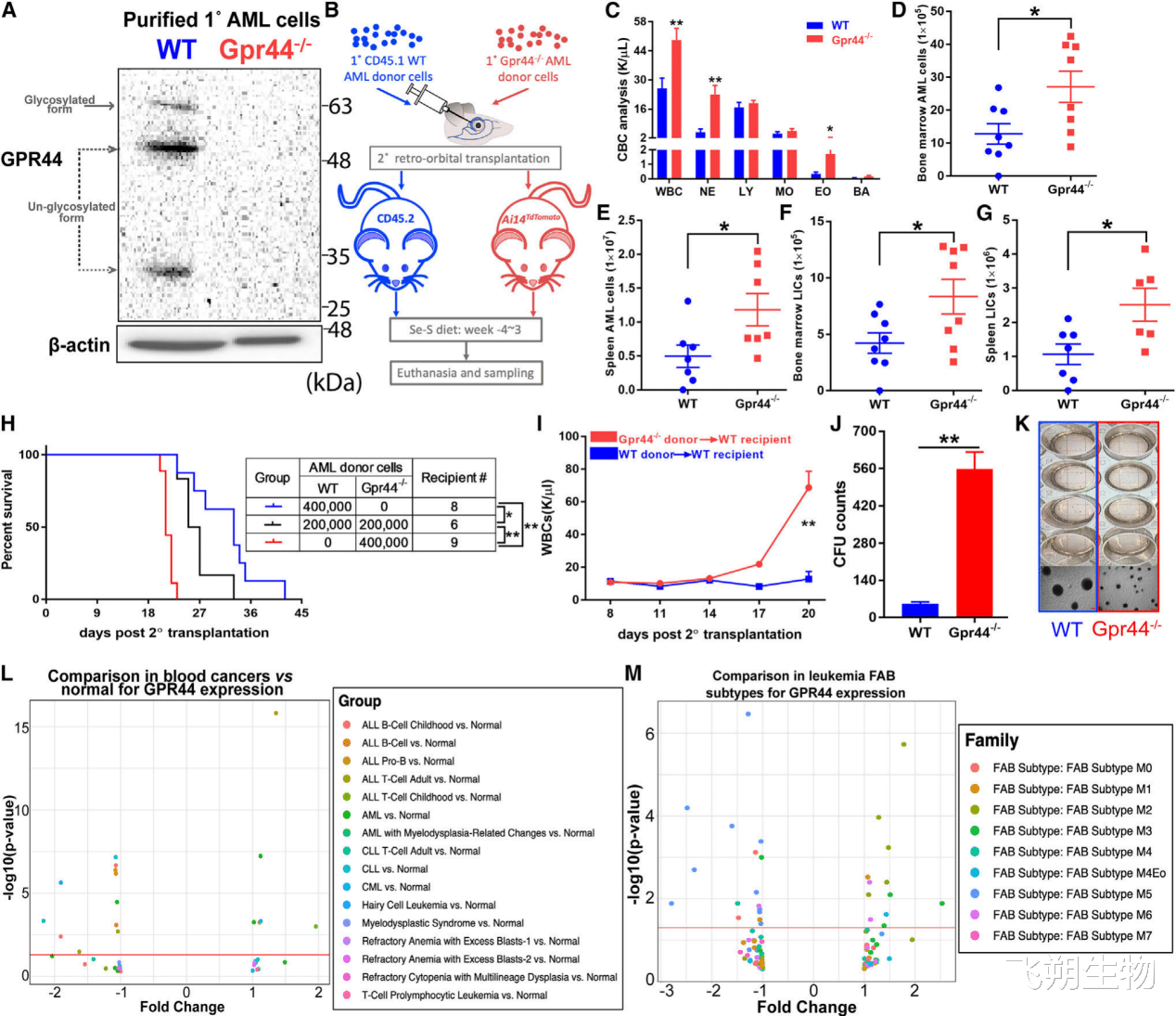
Figure 4. Lack of GPR44 in AML cells results in aggressive disease
PPARγ活性影响Gpr44−/−AML的进展
因为PPARγ和GPR44之间具有相同的配体,所以作者研究了PPARγ和GPR44之间潜在的串扰。用PPARγ选择性拮抗剂GW9662处理Gpr44 -/ -AML细胞的Se-S小鼠,其CBC明显高于对照剂处理的小鼠,脾肿大增加。相比之下,用罗格列酮(一种PPARγ激动剂)治疗的Gpr44 -/ -AML Se-S小鼠显示白细胞水平和脾肿大的减少。总的来说,这些数据表明缺乏GPR44表达的AML细胞仍然可以部分被Se或靶向CyPGs通过PPARγ信号传导,导致细胞死亡可能通过P53激活,但激活GPR44的表达导致对游离AML LICs的反应更强。
缺乏GPR44激活AML细胞中的KRAS-MAPK信号
随后作者对WT和GPR44 -/ -AML LICs进行RNA测序分析,发现GPR44的缺失导致转录程序的显著改变。此外,KRAS在GPR44 -/ -AML细胞中的mRNA和蛋白表达均显著增加。同时还发现在GPR44 -/ -AML细胞中,MAPK成分(RAF、MEK和ERK)的磷酸化增强伴随着RAF-1的表达增加。MAPK信号的下游效应物磷酸化C-JUN的表达增加,进一步证实了GPR44 -/ -AML细胞中MAPK信号的激活,与KRAS-MAPK信号在白血病发生中的作用一致。进一步解释了GPR44 -/ -AML细胞更具有侵袭性。
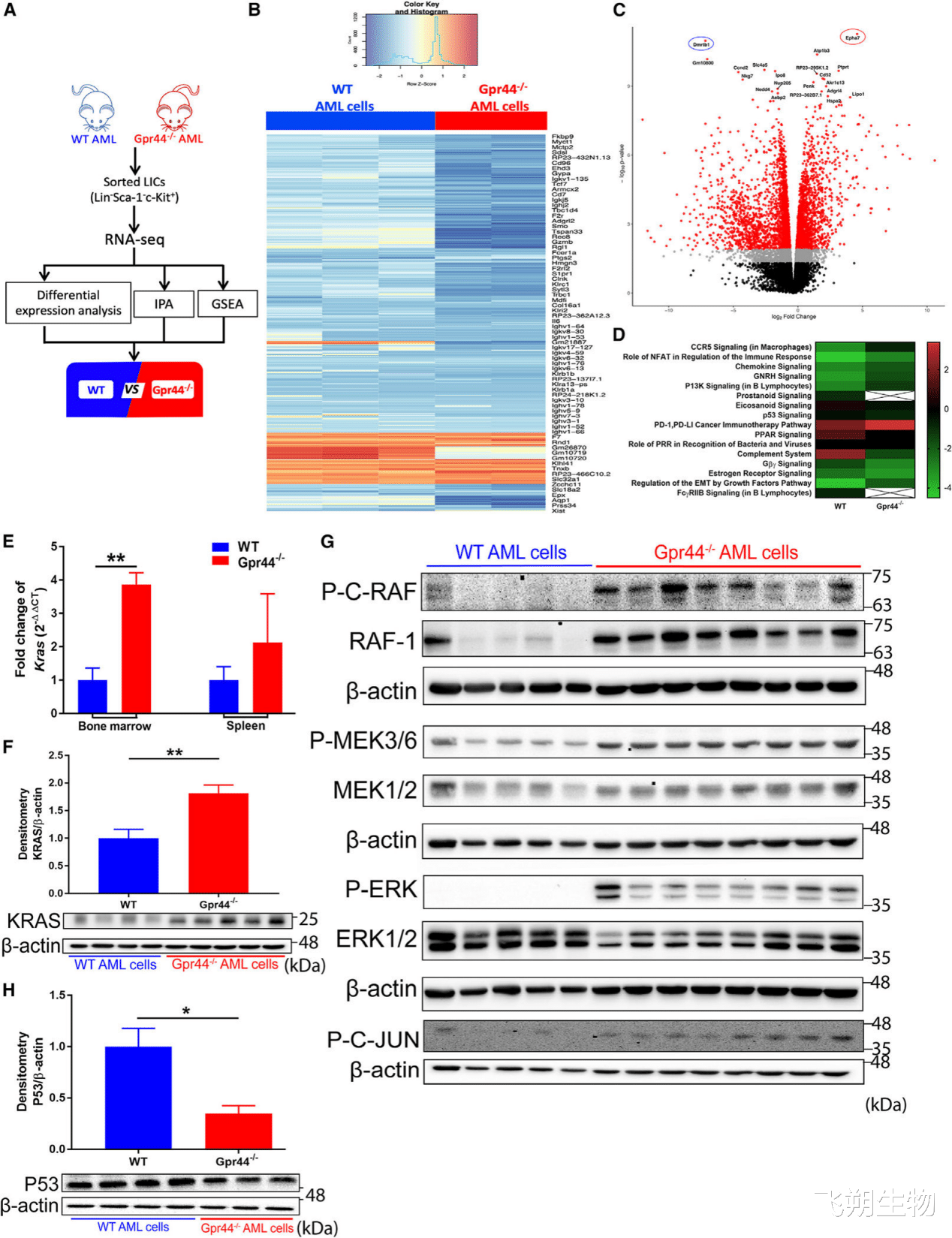
Figure 5. Lack of GPR44 activates KRAS-MAPK signaling in AML cells
抑制KRAS/MAPK信号逆转GPR44敲除对AML的影响
作者使用KRAS抑制剂BAY293、 慢病毒表达dCas9KRAB33和靶向小鼠KRAS启动子的特异性gRNA等方法进行验证。结果显示GPR44 -/ -AML细胞的活力显著降低,抗凋亡基因和细胞周期相关基因的表达显著降低,受体小鼠的存活率也显著提高。
随后作者在体外用MEK选择性抑制剂PD98059处理GPR44 -/ -AML细胞,增加了受体移植小鼠的存活率。pd98059处理的GPR44 -/ -AML细胞显示P-ERK表达降低,P53表达升高,抗凋亡基因、细胞周期相关基因和干细胞静止基因表达减弱。抑制KRAS或MEK均可损害GPR44 -/ -AML细胞的集落形成能力。
总之,这些数据证明了GPR44对KRAS/MAPK信号的调控之间存在一定的联系,这可能在缺乏GPR44的情况下作为逆转AML恶化的替代靶点。
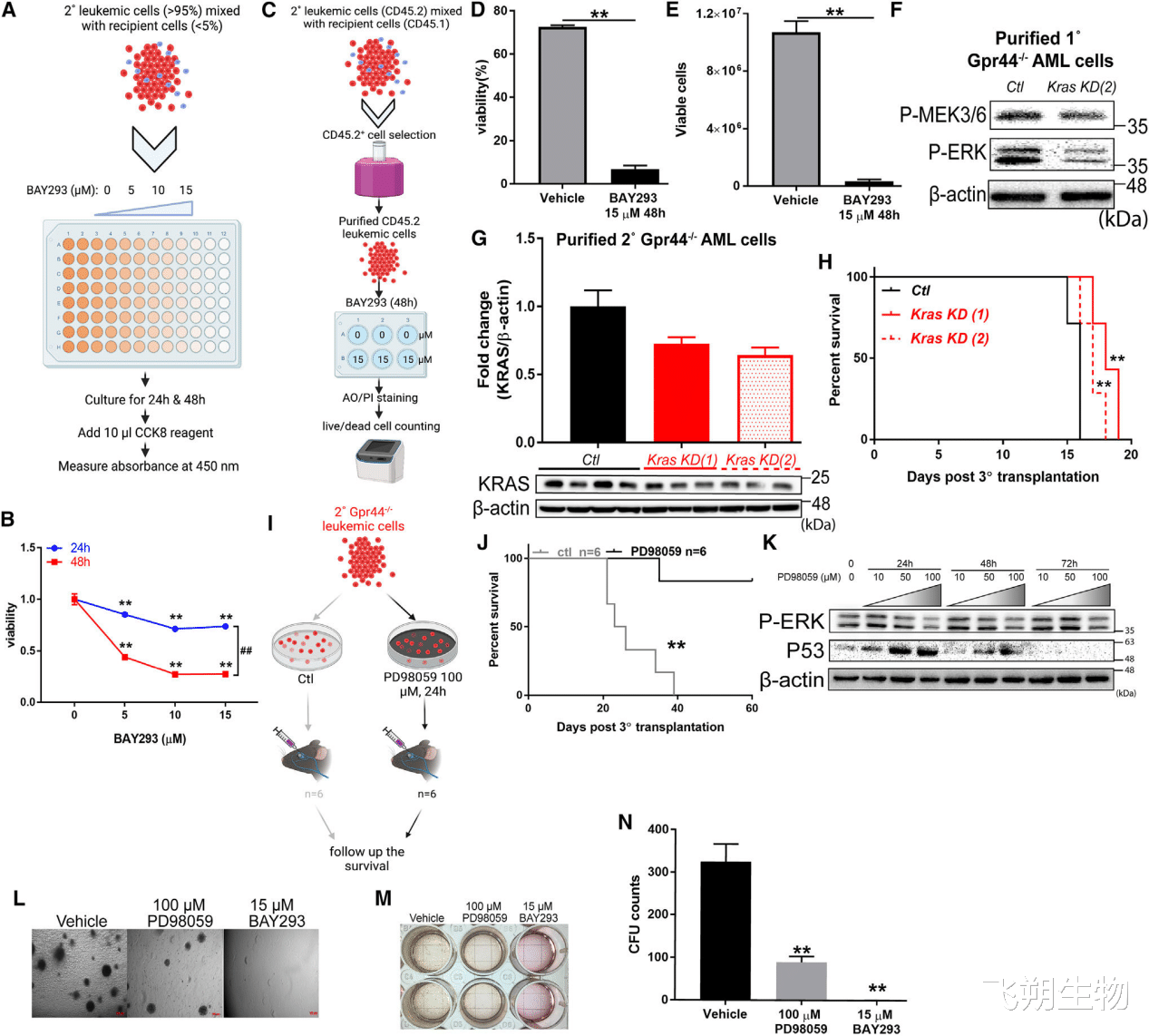
Figure 6. Inhibition of KRAS/MAPK signaling reverses GPR44 KO-associated effect in AML
GPR44的缺失通过激活PI3K/AKT/mTOR通路使AML恶化
KRAS参与PI3K/AKT/mTOR信号通路。因此,作者在WT和GPR44 -/ -AML细胞中进行了评估。在GPR44 -/ -AML细胞中,PI3K和AKT表达及其磷酸化水平显著上调,此外PKA 和PKC的表达增加。PTEN和P-PTEN的急剧下降表明GPR44的缺失可能会对PTEN在AML中的抑瘤作用产生负面影响。使用PI3K (LY294002和Wortmannin)化学抑制剂导致GPR44 -/ -AML细胞的活力降低并抑制了细胞的集落形成能力。表明PI3K在GPR44 -/ -AML细胞中高度表达和激活。

在本研究中,在人类白血病小鼠模型、人类AML细胞系和患者样本中,当GPR44被膳食硒补充后产生的内源性CyPGs(通过COX-H-PGDS途径)或外源性CyPGs激活后导致AML LICs的凋亡。在AML小鼠中,GPR44的缺失通过上调RTK相关的KRAS介导的MAPK和PI3K/AKT/mTOR信号通路加重了疾病。CyPGs对AML或CML小鼠骨髓中的正常造血干细胞没有影响,使其成为一种安全的治疗方案,也可以确保白血病期间正常造血功能的有效康复。