转自:迪安诊断
研究背景
卵巢癌是女性常见的恶性肿瘤之一,因其隐匿性强、早期难以发现,被称为“隐形杀手”。据统计,2020年全球报告了超过31万新病例和约20万死亡病例[1]。BRCA1和BRCA2基因变异是卵巢癌的重要危险因素。BRIP1基因作为BRCA1的“亲密搭档”,同样参与DNA修复,是重要的肿瘤抑制基因。根据美国国家综合癌症网络(NCCN)指南,BRCA1变异携带者终生患卵巢癌的风险高达39-58%,BRCA2为13-29%,而BRIP1则为5-15%[2]。
如果一个人同时携带两种不同基因的致病变异——“胚系双杂合性”(GDH),会发生什么?这正是本次研究关注的焦点。此前,BRCA1/BRCA2双杂合性卵巢癌病例多见于欧洲,亚洲极为罕见,而BRCA1/BRIP1双杂合性卵巢癌病例更是首次被报道。
该研究中纳入患者的临床特征
患者1,46岁女性,被诊断为晚期卵巢腺癌(FIGOIVB期),携带BRCA1:c.3288_3289del(p.Leu1098SerfsTer4)和BRIP1:c.3072del(p.Ser1025HisfsTer34)两种致病变异。
该患者在接受5轮含铂化疗过程中,出现严重的胃肠道副作用而停止化疗。转诊至邵逸夫医院妇产科后,接受3个周期新辅助化疗后手术,术后额外接受了3个周期的含铂化疗。这期间由于1-4级显著的血液学毒性,需要进行多次药物剂量调整,且术后并发乳糜漏,治疗耐受性较差。该患者目前接受奥拉帕利(PARP抑制剂)维持治疗,门诊随访17个月(至2024年底),且没有新的病灶出现,疾病保持稳定。
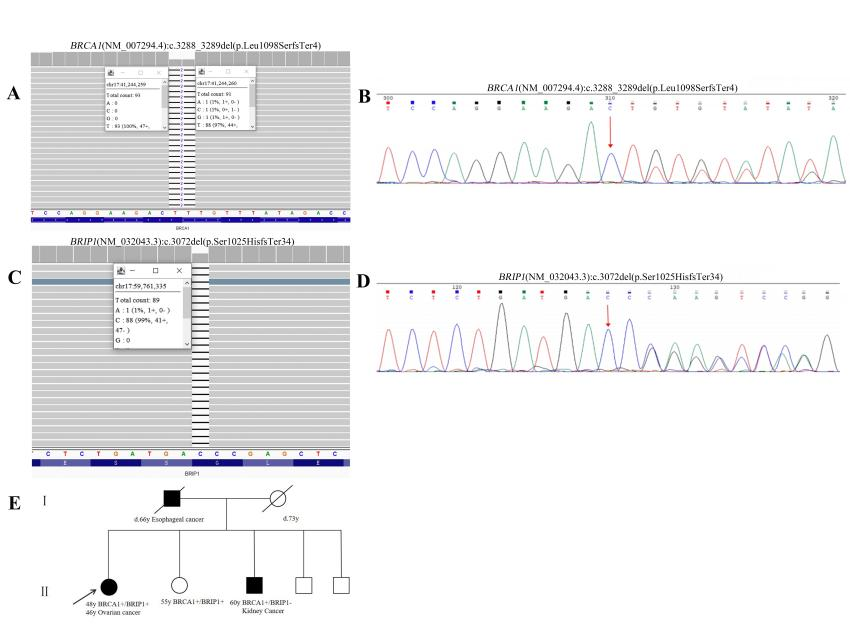
患者1的家系谱图和分子检测结果
患者2,44岁女性,被诊断为高级别浆液性卵巢癌(FIGOIIIC期),携带BRCA1:c.4065_4068del(p.Asn1355LysfsTer10)和BRCA2:c.5073dup(p.Trp1692MetfsTer3)两种致病变异。
该患者耐受化疗良好,完成6个周期含铂方案后接受奥拉帕利维持治疗,随访53个月无疾病复发(至2024年底)。该患者没有出现疾病复发,预后理想。
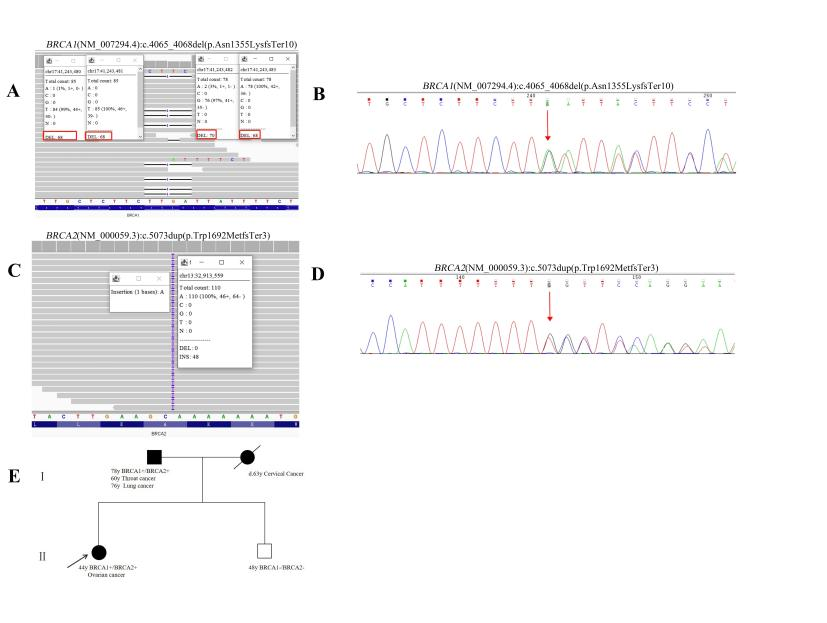
患者2的家系谱图和分子检测结果
精准医疗的启示:
基因组合决定治疗策略
1
GDH的异质性
两例患者均接受了全外显子组测序(WES)确认基因变异,且均获益于PARP抑制剂维持治疗。两位患者虽同为“胚系双杂合性”,但不同的基因组合(BRCA1/BRIP1vs.BRCA1/BRCA2)却带来了截然不同的化疗耐受性和术后恢复。这提示我们,GDH并非一个单一概念,内部存在显著异质性,值得更深入研究。
2
BRCA1/BRIP1组合的挑战
机制上,BRCA1和BRIP1的结构域在DNA修复通路中至关重要。双杂合性变异可能严重削弱细胞修复铂类化疗引起DNA损伤的能力,且BRIP1变异还可能增加血液学毒性风险。临床上,对这类患者应个体化调整化疗剂量,密切监测血液学指标,必要时提前采取支持治疗。
3
PARP抑制剂的普适性
令人鼓舞的是,两名患者都从PARP抑制剂奥拉帕利的维持治疗中获益,病情得到了有效控制。这再次印证了PARP抑制剂在BRCA相关卵巢癌治疗中的重要地位,也为GDH患者提供了有效的靶向治疗选择。
4
早筛与遗传咨询的重要性
在研究中,根据文献统计发现,GDH患者发病年龄可能更年轻,且多为晚期。这提示我们,对于有家族肿瘤史或符合遗传性肿瘤筛查指征的女性,应加强早期筛查和遗传咨询,以便及早发现风险,采取预防或干预措施。
研究小结
本研究首次对卵巢癌中BRCA1/BRIP1GDH变异进行了表征,并将其临床影响与BRCA1/BRCA2GDH变异进行了比较。研究结果强调了不同GDH变异组合对化疗耐受性及治疗效果的影响差异。结果提示,携带BRCA1/BRIP1GDH变异的患者,可能需要针对铂类化疗进行个体化剂量调整,以在最大限度发挥疗效的同时降低毒性。此外,为减轻血液学毒性,或需更频繁地监测全血细胞计数,并及早或预防性使用造血生长因子及提供营养支持。鉴于本研究样本量有限(n=2),且缺乏功能性验证,这些结果需谨慎解读,仅作为生成假设的依据。还需要进一步的功能性和临床研究,以深入阐明其分子机制并优化GDH相关卵巢癌的治疗策略。
随着多基因检测技术的普及,越来越多罕见基因组合将被发现。未来,我们期待通过综合基因信息、临床表现和治疗反应,真正实现“一人一策”,为患者量身定制最佳治疗方案,提升生存质量与预后。
参考文献
[1]HuangJ,ChanWC,NgaiCH,LokV,ZhangL,Lucero-PrisnoDE,etal.WorldwideBurden,RiskFactors,andTemporalTrendsofOvarianCancer:AGlobalStudy.Cancers(Basel).2022Apr29;14(9):2230.
[2]NCCNGuidelinesVersion1.2026:Genetic/FamilialHigh-RiskAssessment:Breast,Ovarian,Pancreatic,andProstate
通讯员:丁东栋祝倩媛