转自:生物谷
阿尔茨海默病(Alzheimer’sdisease,AD)是最常见的痴呆症,患者早期常表现为记忆减退、语言障碍和空间定向困难,随着病情加重,日常生活能力逐步丧失。AD的典型病理特征包括脑内β-淀粉样斑块的沉积和Tau蛋白神经原纤维缠结,尤其以内嗅皮层和海马体最早受累,导致突触损伤和神经元退行。然而,为什么在AD的病程中,这些关键脑区和特定细胞类型如此易受损,其背后的分子机制长期未明。
值得注意的是,一些个体即使在大脑中存在较高AD病理负荷(如大量斑块和缠结)的情况下,仍能维持较好的认知功能,这种现象被称为“认知抵抗力/认知韧性”(Cognitiveresilience,CR)。CR的存在提示神经系统可能具备抵御或缓冲病理损伤的细胞与分子机制。探索CR的表观遗传和转录调控基础,不仅有助于阐明AD的发病机制,也为开发延缓认知衰退的新型干预策略提供重要启示。因此,揭示AD脑区和细胞类型的易感性,以及CR个体如何维持认知功能,成为AD研究的关键科学问题。
2025年8月1日,来自麻省理工学院计算与人工智能系ManolisKellis与PicowerInstitute的蔡立慧(Li-HueiTsai)研究组的刘尊鹏博士和张珊珊博士等在Cell上发表了题为Single-cellmultiregionepigenomicrewiringinAlzheimer’sdiseaseprogressionandcognitiveresilience的研究论文。该研究首次跨越六大关键脑区,在111例AD患者及对照样本中,运用单细胞表观基因组、转录组与多组学技术,系统地描绘了从表观调控到基因转录的全景图谱。
研究人员量化了“表观基因组信息”(epigenomicinformation),并将其与AD病理负荷、认知衰退、认知韧性、胶质细胞状态、遗传风险及转录调控进行系统整合分析,揭示了脑区和细胞类型特异的表观调控网络如何在病理条件下影响神经元与胶质细胞的功能与命运转化,强调了表观基因组稳定性在认知保护中的核心作用,为理解AD进程中的认知衰退机制与细胞退行提供了全新视角。

研究团队选取了111位个体(其中57例为非AD、33例为早期AD、21例为晚期AD),涵盖6个脑区(内嗅皮层、海马体、丘脑、角回、中颞皮层和前额叶皮层),共采集384份脑组织样本,构建了799个单细胞转录组、表观基因组及多组学文库,共获得约350万个细胞的高质量表观基因组与转录组图谱。
通过对单细胞表观基因组与转录组数据的深度整合,该研究绘制了一个涵盖7大类细胞、67个细胞亚型的高分辨率跨脑区单细胞表观和转录全景图谱,系统鉴定了超过100万个顺式调控元件,并定义了123个功能模块。进一步分析揭示,阿尔茨海默病、精神疾病及免疫相关脑性状的遗传风险位点呈现细胞类型特异性关联,为深入解析脑疾病的分子机制和开发精准干预策略提供了关键资源。
该研究揭示了AD脑中普遍存在“表观基因组信息丢失”的现象:异染色质松弛与活性染色质功能减弱并存,这种“表观基因组侵蚀”与神经元及胶质细胞的功能衰退高度相关。进一步分析发现,不同脑区和细胞类型在易感性上存在显著差异,其中内嗅皮层和海马体等AD高易感区域的兴奋性神经元、齿状回颗粒细胞和锥体细胞受损最为严重。
此外,胶质细胞在AD进程中呈现出“激活—耗竭”的双相状态:在早期激活阶段,小胶质细胞和星形胶质细胞的表观信息水平逐渐升高,进入疾病响应状态,并在峰值阶段显著富集ADGWAS遗传风险位点,提示遗传易感性与表观基因组动态存在高度耦合;然而,随着AD病理进展和炎症反应的持续,这些“激活态”胶质细胞逐渐进入“耗竭”状态,表现为表观信息丢失与功能耗竭,修复与稳态维持能力下降,从而加重神经退行性损伤。
该研究还深入解析了“认知抵抗力/认知韧性”的表观基因组基础。通过量化临床认知评分与病理负荷的差异,研究将受试者分为认知易损组、中间组和抵抗组。结果显示,具有较强认知韧性的个体在兴奋性神经元、少突胶质细胞和小胶质细胞等关键亚型中普遍保有更高的表观基因组信息。此外,认知韧性组的“激活态”胶质细胞能够持续维持表观稳定性,而易损组则出现明显的表观衰竭。该发现表明,表观基因组稳定性是支撑认知韧性的关键分子机制,为通过表观遗传干预增强认知功能、延缓AD进展提供了全新思路。
最后,研究者发现核结构完整性或是维系表观稳定性的关键“支撑梁”。研究人员深入探究了表观基因组稳态维持和损坏的关键调控网络,发现核纤层蛋白、异染色质支架等因子共同维护染色质的三维空间组织与转录精度;相反,免疫通路的异常激活会催化基因组稳定性的丧失,加速细胞退行。
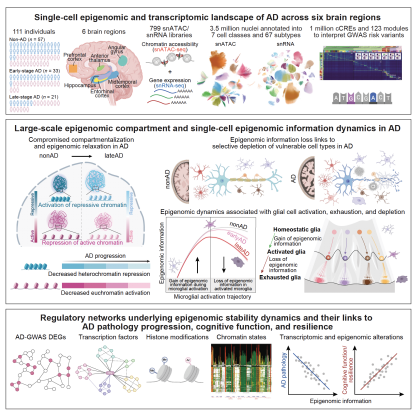
图:跨脑区单细胞多组学系统剖析阿尔兹海默病和认知韧性的多维表观调控分子机制
综上所述,本研究通过跨脑区、多层次的单细胞多组学分析,深入阐明了AD进程中表观基因组稳态失衡与“认知韧性”的守护机制,为后续基于表观基因组稳定性和完整性的治疗策略提供了重要理论基础,为AD的精准治疗开辟新路径。
麻省理工学院计算机与人工智能系ManolisKellis实验室研究科学家刘尊鹏博士为论文的第一作者兼共同通讯作者。麻省理工学院计算机与人工智能系ManolisKellis教授和PicowerInstitute的蔡立慧(Li-HueiTsai)教授为论文的共同通讯作者。麻省理工学院计算机与人工智能系ManolisKellis实验室博士后张珊珊博士为论文的共同第一作者。该研究得到浙江大学良渚实验室熊旭深研究员、波士顿大学侯磊教授,麻省理工学院Whitehead研究所孙娜研究员、北京大学公共卫生学院韩西坤研究员、北卡罗来纳大学教堂山分校陈天龙教授的大力指导及支持。
论文链接:
https://doi.org/10.1016/j.cell.2025.06.031