2025年8月1日,乐普生物董事会欣然宣布,本公司(作为许可方及转让方)与Excalipoint(作为受许可方及受让方)就集团专有的T细胞衔接器TOPabody平台开发的两个早期资产的部分知识产权,签署了《知识产权转让与许可协议》及《股份购买协议》,以进行许可及/或转让交易。根据上述协议,并在其条款与条件约束下,Excalipoint将获得目标产品在全球范围内的独家开发及商业化权利。作为对价,本公司将获得以下收益:
总计1,000万美元的现金预付款,以及10%的Excalipoint的股权;
总额最高可达8.475亿美元的研发及商业化里程碑付款;
按销售额分级计算的销售提成。
此外,本公司有权委派一名董事进入Excalipoint董事会。
在上述许可交易的同时,Excalipoint将完成A轮融资。由红杉中国、元生创投及杏泽资本担任联合领投方,其他A轮投资方包括五源资本、凯风创投、幂方健康基金及弘毅投资等,将依据《股份购买协议》的条款,合计向Excalipoint投资4,100万美元。
董事会认为,与Excalipoint的许可交易及Excalipoint的A轮融资的成功,充分挖掘了现有产品管线和技术的商业价值,有利于推动公司实现全球化战略布局。此外,此项交易也将助力公司聚焦于下一代抗体偶联药物(ADC)及免疫肿瘤双/三特异性抗体的战略性研发重点,加速后期产品的商业化进程。
自此,乐普生物通过CMG901AZ授权(CLDN-18.2)ADC平台出海、MRG007自研创新分子出海,以及此次与知名基金联合成立Newco,已实现多元化的交易模式与价值兑现。
CDH17ADC
乐普生物一度被低估,2025年1月22日,乐普生物宣布,与ArriVentBioPharma,Inc.(纳斯达克:AVBP)就针对消化道癌的潜在同类最佳抗体偶联药物MRG007达成全球独家许可协议。
根据协议,乐普生物授予ArriVent在大中华区(包括中国大陆、中国香港、中国澳门和中国台湾)以外地区开发、制造和商业化MRG007的全球独家许可。乐普生物将获得总计4700万美元的一次性首付款和近期里程碑付款,和最高达11.6亿美元的开发、注册和销售等里程碑付款,以及基于大中华区以外地区净销售额的分级特许权使用费。
MRG007在消化道癌的临床前模型中表现出优越的抗肿瘤活性,初步临床开发重点是结直肠癌、胰腺癌及其他消化道恶性肿瘤。
根据其适应症判断为一款CDH17ADC。后来证明确实为CDH17ADC。
体外实验展现了优异的活性。后续临床爬坡可能也需要一定摸索。通过体外活性,还可以判断一点CDH17表达量是非常优异的,而且特异性也较好。通常的很多靶点DXDADC是做不出体外活性的,因为表达量和内吞能力的限制。
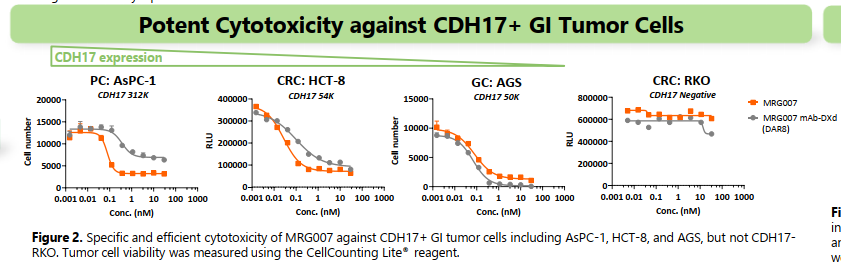
体内药效实验优异。
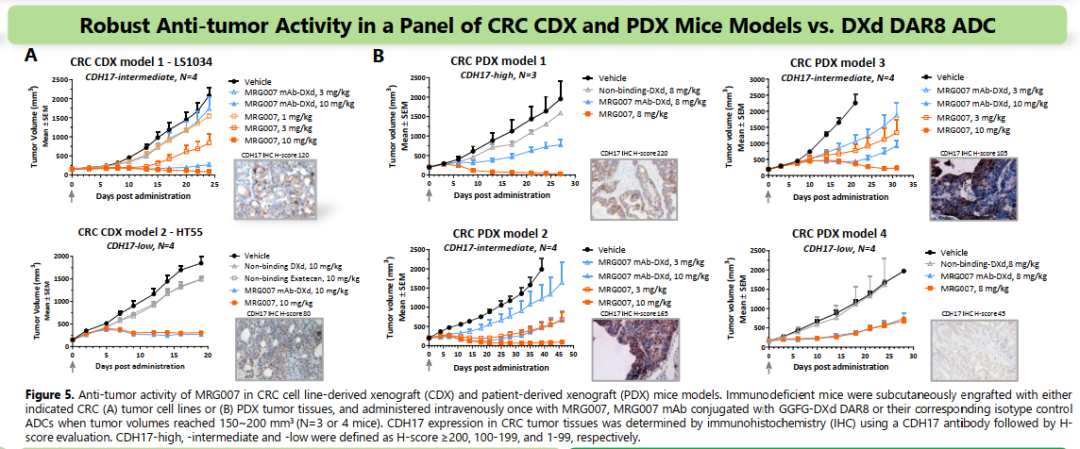
非GLP毒理研究,在恒河猴中多次静脉输注MRG007(剂量为30和60mg/kg)后表现出良好的耐受性,在接受60mg/kg剂量的雌性猴中观察到轻微且可逆的稀便/软便。临床病理检查(包括血细胞、凝血功能及生化指标)未见显著异常变化两次给药后呈剂量依赖的毒代动力学(TK)特征,外周载荷释放极少。

GPC3ADC
同时,根据GPC3在肝部高表达,开发了GPC3ADC,MRG006A。在体外展现了优异杀伤活性。
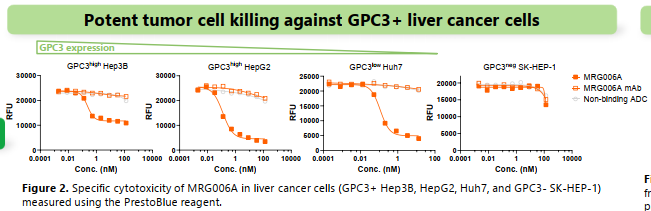
体内效果同样优异。
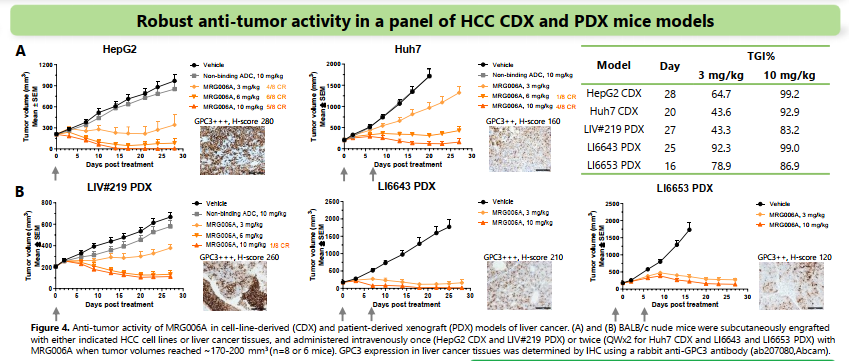
针对肝癌一直以来化疗系统性给药不理想,所以肝动脉化疗栓塞术是比较重要应对策略,但给药方式麻烦且困难。通过ADC进行肿瘤定位,进而依赖ADC缓释的效果,可能会解决目前化疗系统性给药在肝癌中的尴尬窘境。
TFADC
TF作为成药靶点,世界范围布局的热度并不高。通过对比其它成药或即将成药靶点的表达水平来看,TF并不算差,尤其在胰腺癌中表达水平较高。宫颈癌,头颈癌,肺腺癌,肺鳞癌,前列腺癌中也有非常优异的表达。
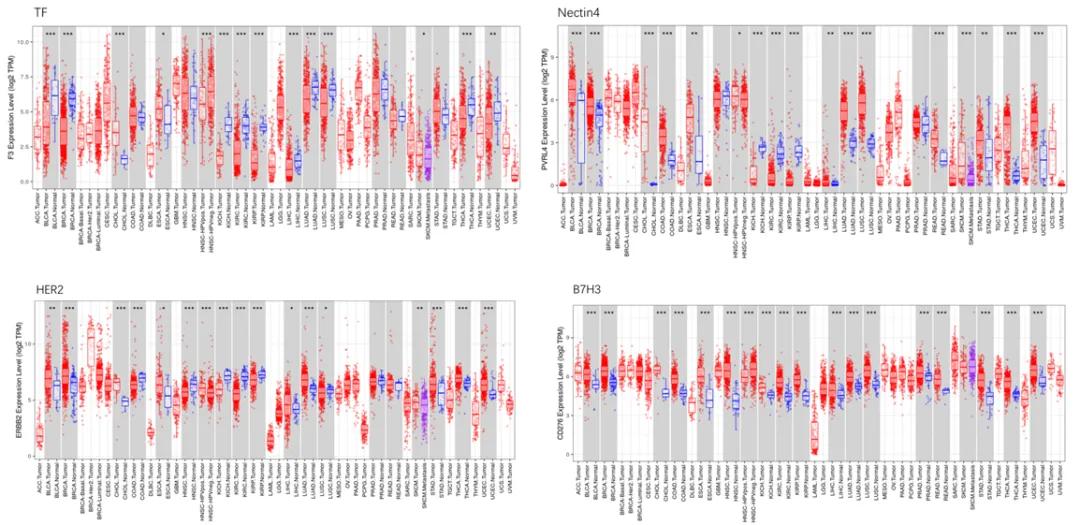
TF不失为一个被忽略的好靶点。
乐普将TFADC拓展到胰腺癌领域需要非常大的勇气,但也可以看出,随着探索的逐步深入,我们的认知也在不断地被打破。原来治疗胰腺癌还是有一定希望,同时信达生物的CLDN18.2ADC,CD3/CLDN18.2双抗在胰腺癌中都表现了初步优异的疗效。
乐普的TFADC,内部编号MRG004A,采用的是Synaffix的糖定点偶联技术,payload为MMAE,DAR值为4。
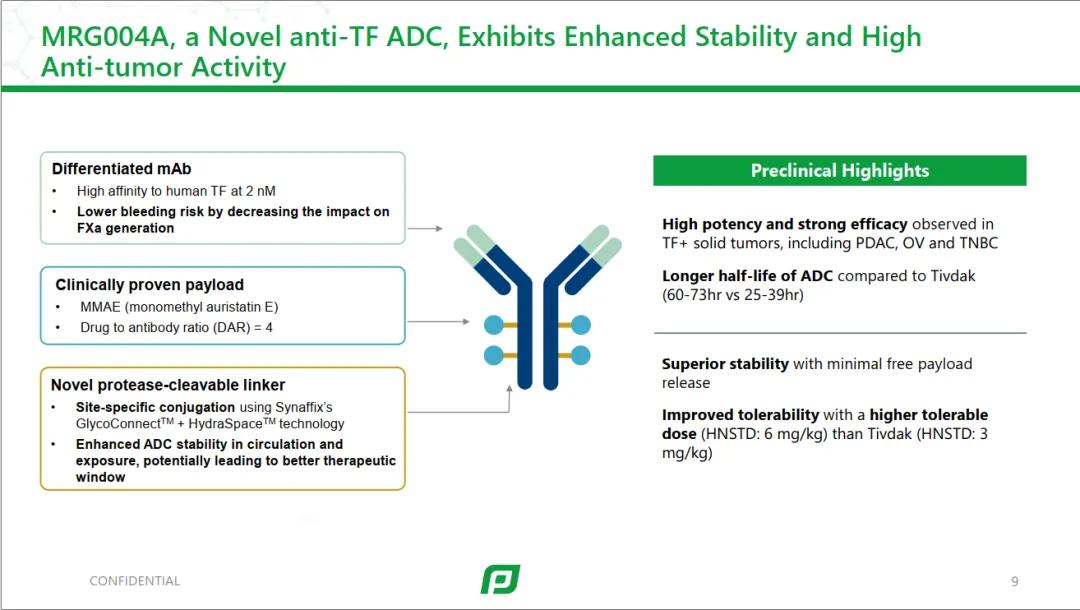
从目前的数据来看,MMAE能够成药,DXD平台也有很大的成药的可能。两者可以作为机制互补性联用方案。这为未来胰腺癌的治疗提供了很大空间。
在临床前的体内药效数据中,相比于非定点偶联,MRG004A展现了不错的效果。
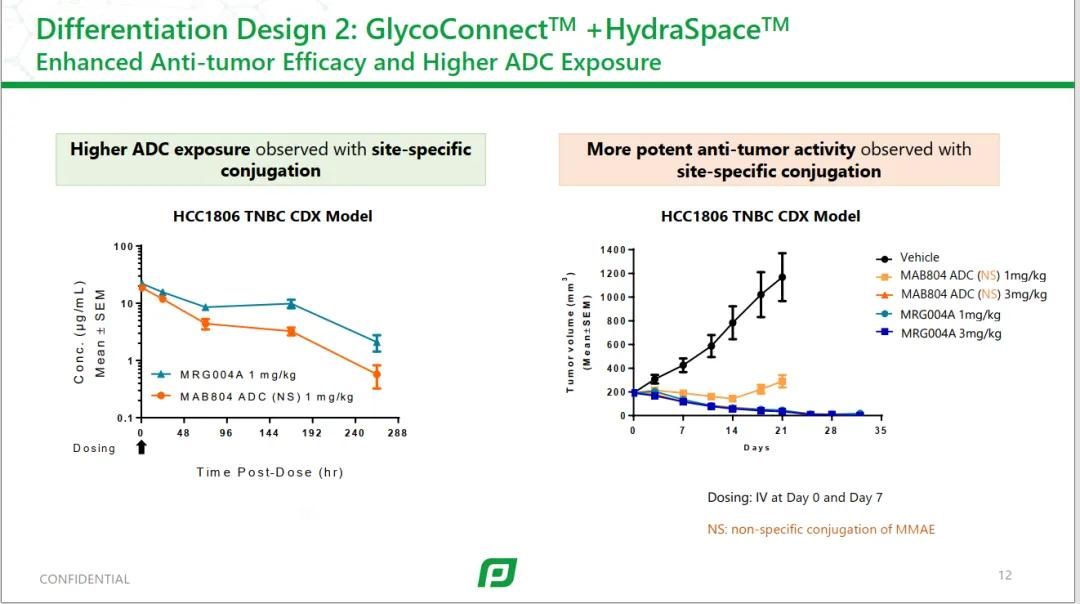
在多种PDX模型中,效果优异。
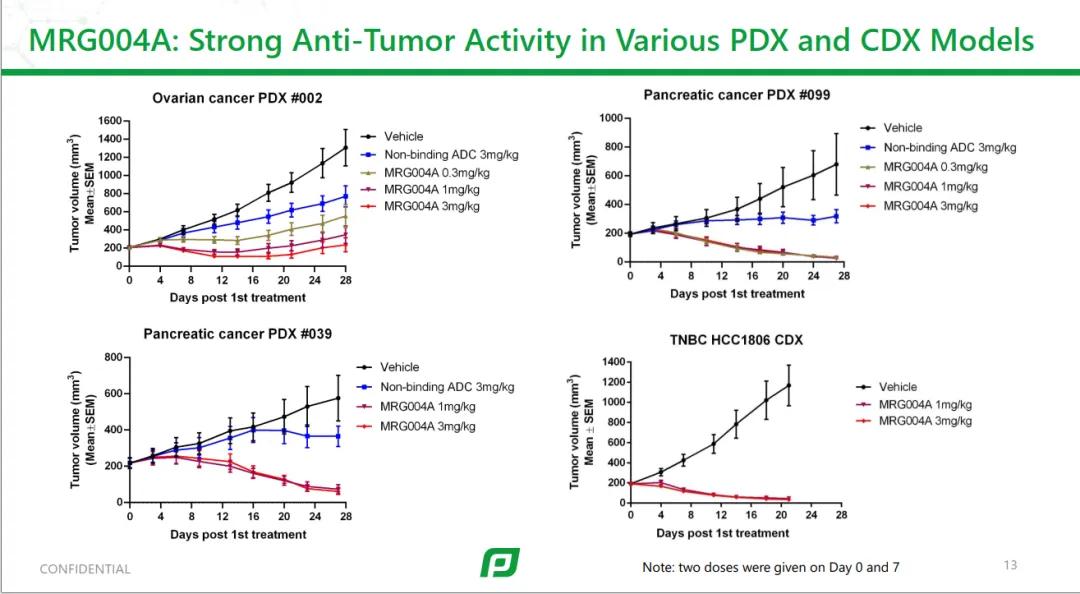
在2024年ASCO上展现了优异的临床初步疗效,为未来单药或者不同机制ADC联用,打下了基础。以我做研发的视角来看,不同表位的抗体,成为一种机会,实现不同机制毒素,不同表位抗体ADC联用。当然,也可以采用双毒素payload,但这个设计的复杂性要高很多。
在本次ASCO中展现的临床数据,入组63名患者,其中43名在剂量递增阶段(8个剂量水平[0.3-2.6mg/kg]),20名在剂量扩展阶段(15名2.0mg/kg,5名2.4mg/kg)。患者的中位年龄为58岁(范围:38-75岁),ECOG评分为0的患者有8名(13%)。女性患者有37名(59%)。既往中位治疗线数为3(范围:1-10)。在本研究中,未达到最大耐受剂量(MTD)。60个基线样本通过免疫组化评估总体膜阳性率,19例为胰腺癌(PC),68%(13/19)的TF表达率≥50%且强度为2或3(+)。5例患者接受了