大家好!今天来了解一篇关于细胞分选技术的研究文章——《High-throughput single-cell sorting by stimulated Raman-activated cell ejection》发表于《SCIENCE ADVANCES》。细胞分选技术一直是生物学研究中的关键领域,它能帮助我们从复杂的细胞群体中分离出特定细胞,以深入探究细胞的奥秘。然而,现有的细胞分选技术,如流式细胞术、激光显微切割等,存在着各种问题,像荧光标记可能影响细胞功能,无标记分选特异性不足等。拉曼光谱技术虽有优势,但传统的拉曼激活细胞分选技术通量较低。S-RACE技术,有望解决这些难题,一起去看看吧!
*本文只做阅读笔记分享*
一、研究背景
细胞分选在生物研究中十分重要,它有助于从不同角度分析异质细胞群体,包括化学、结构和基因组等方面。目前已有的细胞分选技术,如流式细胞术、激光显微切割、细胞挑选和微流控等,都存在各自的问题。例如,荧光和磁性标记常用于分选目标细胞,但外源标签可能具有细胞毒性并干扰细胞功能。而且缺乏特异性标签以及易受光漂白等问题,也限制了基于标记的细胞分选技术的应用。相比之下,无标记的细胞分选方法虽依靠细胞形态和可变形性等特性,但这些特性与生物状态的直接相关性不强,导致分选特异性降低。像定量相位成像能绘制折射率体积分布,却难以识别特定细胞。
拉曼光谱技术则具有独特优势,它通过检测非弹性光子散射来表征单细胞的内源化学成分,还能探测细胞代谢活性。将拉曼光谱与细胞分选方法结合,已在多个生物医学应用中取得成果。不过,拉曼激活细胞分选(RACS)技术虽能在微生物学中发挥作用,如从复杂环境中分离功能性个体,但当前RACS方法因自发拉曼散射截面小,通量较低。例如,生物样品单个拉曼测量的典型积分时间为15-60秒/光谱,以获取足够信噪比。
二、S-RACE平台
1、系统构成
S-RACE系统主要包含多光谱SRS显微镜和激光喷射模块。
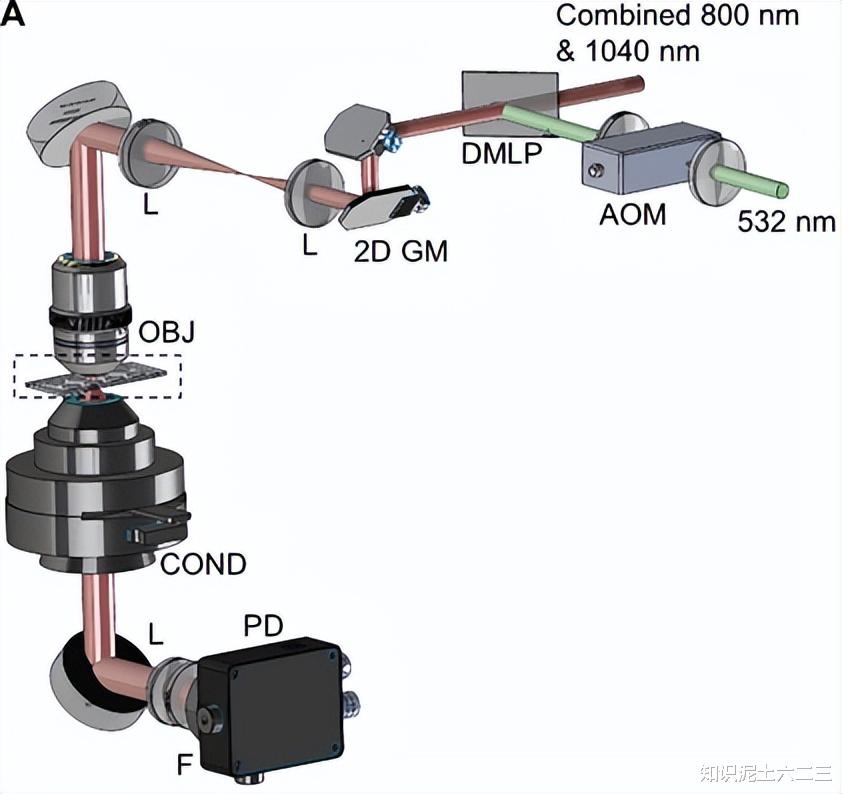
SRS显微镜在之前的研究中已有详细描述。通过扫描光谱啁啾的泵浦光和斯托克斯光之间的脉冲延迟,可采集多色SRS堆叠图像。激光喷射模块由532nm、1.0ns脉冲激光、喷射盖玻片和收集器组成,它们呈三明治状组装。

喷射盖玻片涂有一层二氧化钛(TiO₂)作为动态释放层,例如在聚合物微粒混合物分选实验中,样品先加载到TiO₂涂层的盖玻片上,空气干燥后准备喷射。532nm激光透过盖玻片时,TiO₂涂层吸收激光能量,经历四个阶段的转变,推动目标微粒离开。收集器由在标准盖玻片上涂覆一层聚二甲基硅氧烷(PDMS)制成,用于收集“喷射”出的微粒。对于活细胞分选,会在TiO₂涂层上引入一层薄琼脂糖凝胶,在收集器底部也引入互补的琼脂糖层,以减轻细胞在喷射和着陆过程中的损伤。对于组织样本,冷冻切片组织先固定在TiO₂涂层盖玻片上,根据SRS图像选择感兴趣区域(ROI),然后将切割区域收集到收集器中。
在测试多种涂层后,发现TiO₂在SRS成像和激光喷射中表现最佳,其150nm厚的涂层通过磁控溅射制备,溅射时间2分钟,厚度4nm。

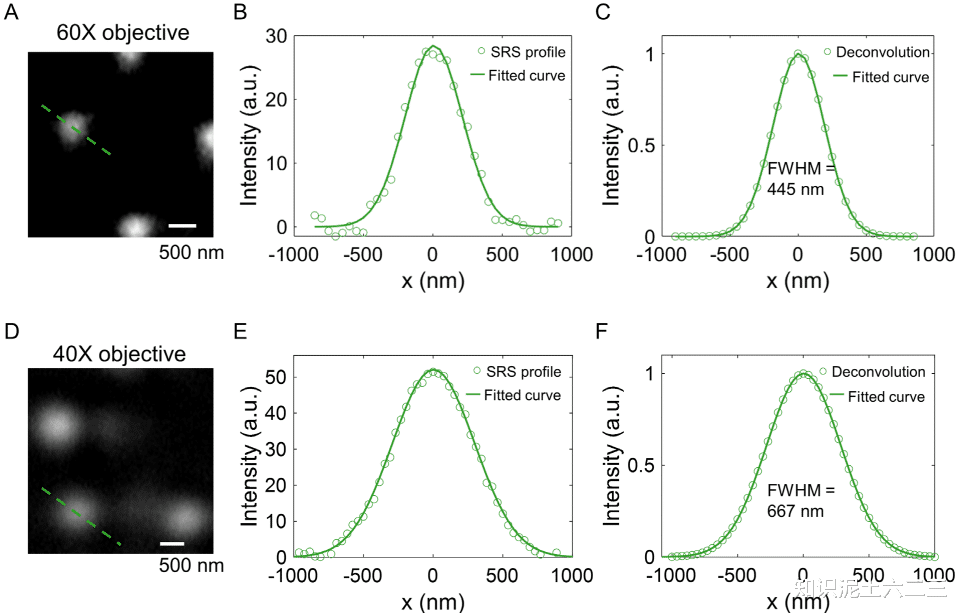
TiO₂涂层在SRS成像中背景最小,与聚合物微珠的SRS信号无干扰,而常用的金涂层盖玻片会给SRS图像带来较大热背景。TiO₂涂层的紫外-可见光谱在532nm处有吸收峰,利于激光喷射,且在喷射后分析中背景也小,证实了S-RACE系统的可行性。通过用干燥在TiO₂涂层盖玻片上的微珠簇测试,发现60×物镜下喷射斑直径为4.20±0.74μm,40×物镜下为6.19±1.00μm,喷射斑大于光学分辨率可能是“涟漪效应”所致,测试使用的激光能量确保成功喷射且无光损伤,物镜前激光功率低于1.5mW,激光脉冲能量小于1μJ。进一步研究轴向焦位置对喷射效率的影响,发现物镜聚焦在TiO₂涂层(微珠上方约1μm处)时效率最高。

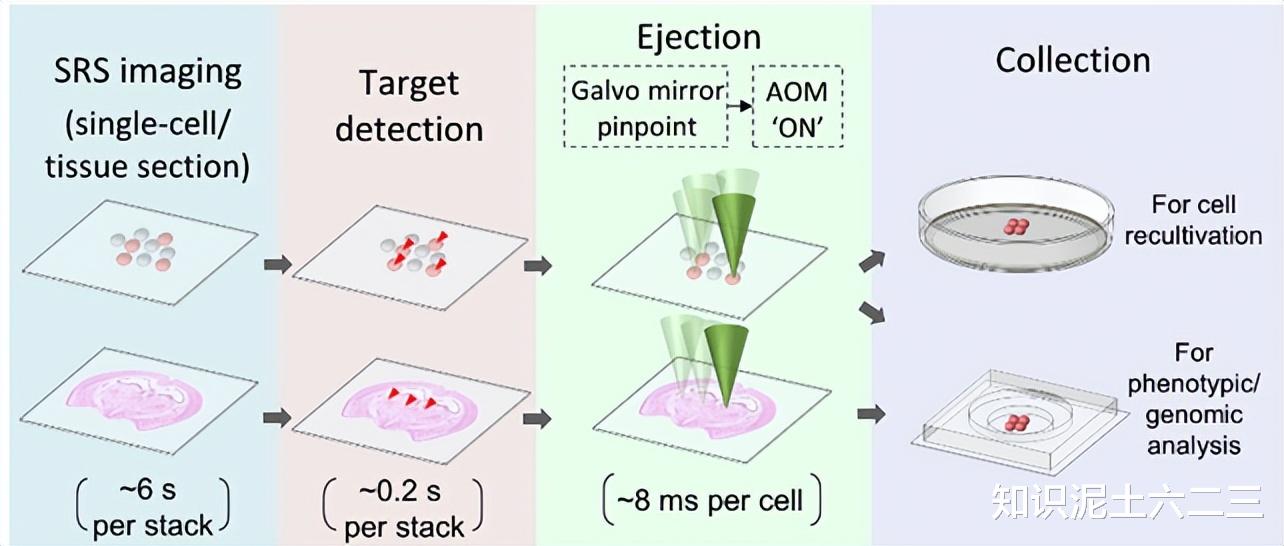
2、工作流程
S-RACE的工作流程。

对于每个视野(FOV),首先以10μs像素停留时间采集SRS图像,一个300×300像素、四个波数的SRS堆叠图像采集约需6秒,60×1.2NA物镜下空间分辨率为460±15nm。
随后通过光谱分析识别FOV内的微粒/细胞,如在涉及两种聚合物微珠的四色SRS图像中识别目标物体,此目标检测步骤约需0.2秒。对于每个目标微粒/细胞,使用二维振镜将绿色激光精确定位在物体上,激活声光调制器(AOM)发射532nm、4kHz激光到涂层上,目标物体被推离喷射盖玻片并被收集器盖玻片接收。AOM作为快速脉冲选择器,实现单脉冲喷射,每次喷射约需8ms,足以稳定二维振镜精确定位并补偿激光重复率。通过移动样品台拼接多个FOV以实现高通量。分选完目标细胞后,可对收集器中的细胞进行下游表型和/或基因组分析,如测序和蛋白质组学分析。
3、性能评估
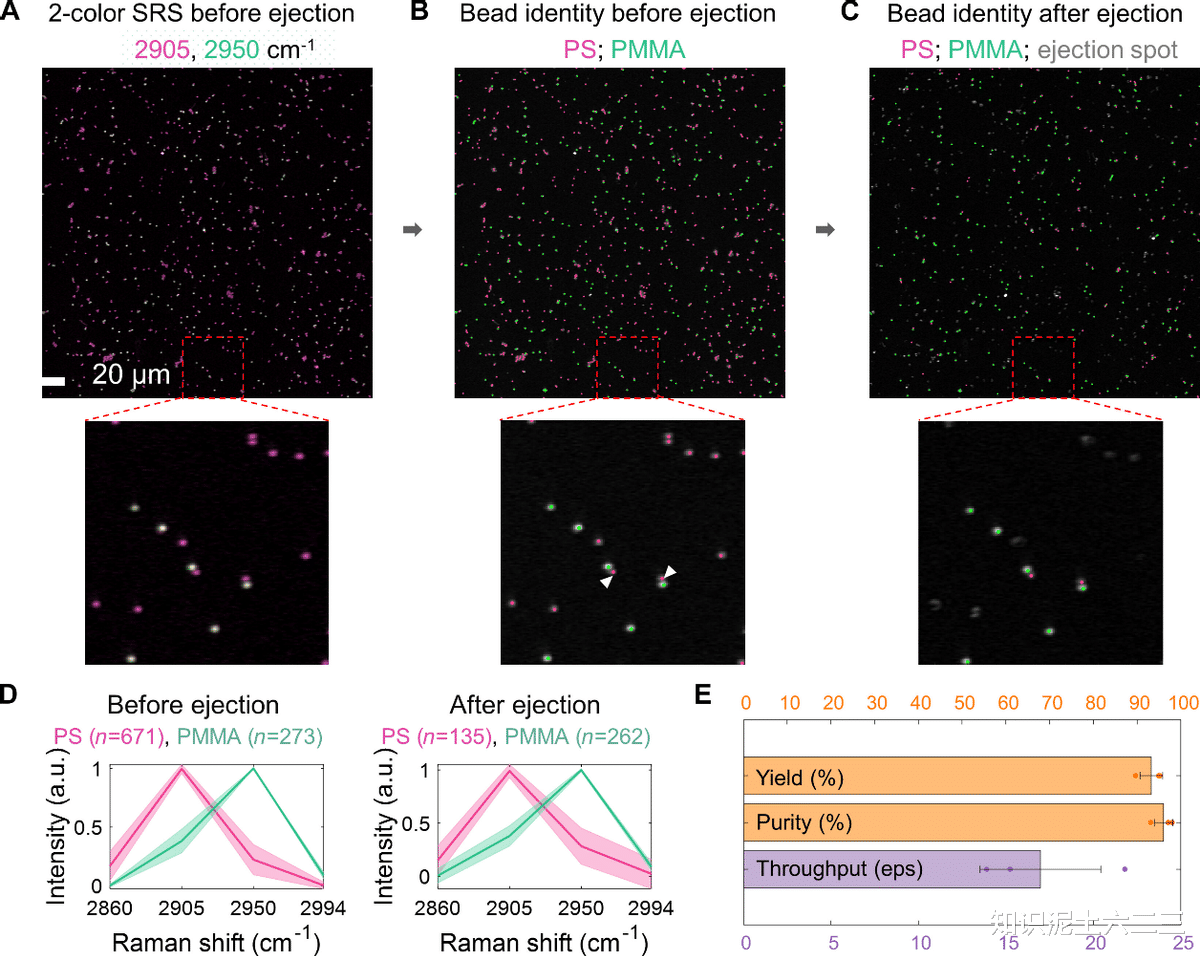
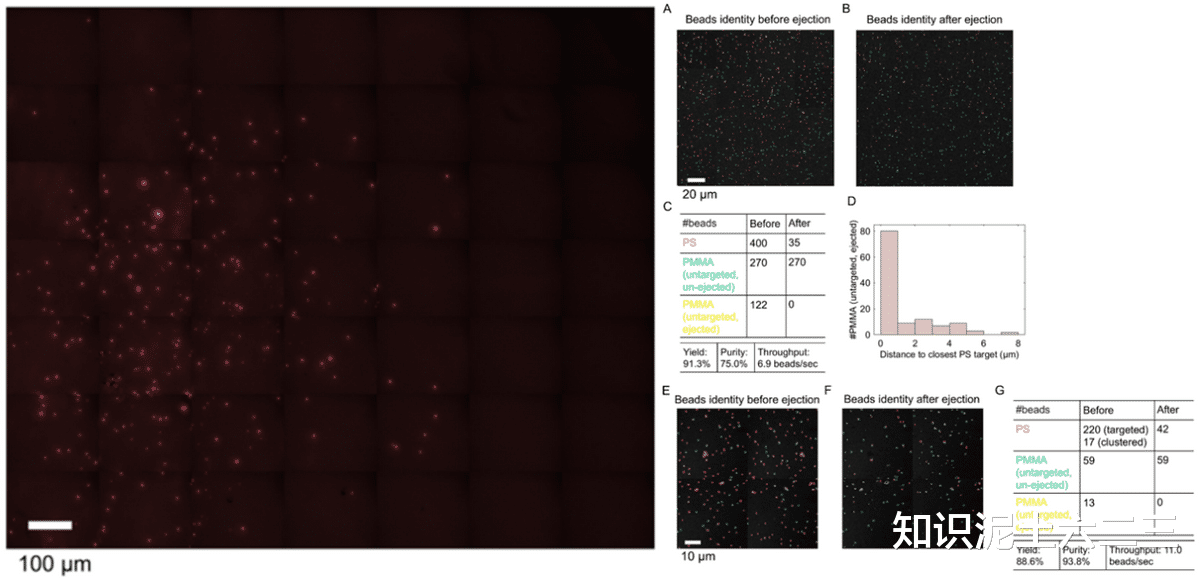
使用聚合物微珠混合物(直径1.0μm的聚苯乙烯(PS)微珠,有红色荧光;聚甲基丙烯酸甲酯(PMMA)微珠,无荧光)测试S-RACE性能。选择代表PS(2905cm⁻¹)和PMMA(2950cm⁻¹)拉曼特征的四个波数(2860、2905、2950和2994cm⁻¹),实验采用(顶部)配置(60×物镜),聚焦尺寸小。

喷射前双色SRS合成图像,将所有微珠分为PS或PMMA两类,PS微珠为目标进行分选。分类后微珠的彩色标记复合SRS图像,为提高分选纯度,排除与相邻PMMA微珠距离小于2.5μm的PS微珠(“聚集”PS)。喷射后微珠的身份,白色箭头指示的相邻PS微珠的PMMA微珠在PS微珠喷射后保留。喷射前后微珠的平均光谱,证实了微珠分类。实验中观察到喷射后盖玻片上有亮点残留,其光谱与PS或PMMA不同,可能是TiO₂涂层变形所致。对喷射性能量化,S-RACE实现了93.3±2.6%的产量、96.2±2.1%的纯度和约17.0±3.5事件/秒(eps)的通量,结果来自三次重复实验,平均分离536个微珠。
由于PS微珠有红色荧光,可用宽场荧光定量收集器中的PS微珠,发现收集器中有292个PS微珠,收集率约55%。不同微珠排除标准的实验表明,更严格的排除标准可提高纯度。
三、S-RACE对活细胞的适用性
为验证S-RACE平台分选单活细胞的生物相容性,我们对酿酒酵母、白色念珠菌和大肠杆菌(分别代表真核和原核细胞)进行测试。为保护活细胞免受热和机械损伤,我们采用类似Liang等人和Hong等人的方案,在TiO₂涂层上制备琼脂糖层,显微镜下估计其厚度为6.25±0.95μm。基于明场成像识别琼脂糖凝胶上的白色念珠菌单个细胞,明场图像分析得出喷射产量为92.9±3.9%,纯度为78.2±1.9%。

尽管细胞较大,但纯度与无邻居排除标准的1.0μm聚合物微珠结果相似,这是因为附着在目标细胞上的细胞比例较高。而且,与无琼脂糖层的1.0μm聚合物微珠喷射相比,添加琼脂糖层进行活细胞喷射在喷射产量和纯度上无明显差异。完成所有目标细胞喷射后,将带有分选细胞的琼脂糖板置于30°C(真菌)或37°C(细菌)的培养箱中,通过回收菌落数与喷射细胞数的比例确定培养回收率,大肠杆菌的培养率为19.5±3.0%。活酿酒酵母喷射的性能评估。此外,琼脂糖凝胶和TiO₂碎片可忽略不计,显微镜下未观察到,表明对细胞培养影响有限,从而确定了活细胞喷射的涂层条件。

为评估S-RACE过程中SRS激光辐射对活细胞活力的影响,对经SRS激光辐射后的大肠杆菌进行时移成像,选择三种不同的SRS激光辐射水平:无辐射、低辐射(泵浦24mW,斯托克斯50mW)和中辐射(泵浦24mW,斯托克斯100mW),中辐射水平比实验条件更严格。大肠杆菌细胞从液体培养物取样后滴在1%琼脂糖垫上,用盖玻片夹住,置于30°C的封闭培养箱中。在所有三种激光辐射水平下,均观察到细胞生长和菌落形成,通过拟合细胞菌落面积的生长曲线计算生长率,发现三种辐射水平下生长率无显著差异,证实了SRS激光辐射的生物相容性。

接着对酿酒酵母和绿色荧光蛋白(GFP)标记的大肠杆菌两种活细胞进行S-RACE。基于2935cm⁻¹的单帧SRS图像识别单个酿酒酵母细胞(信噪比约4),喷射后的SRS图像,图中的亮点可能是变形的琼脂糖层和/或TiO₂涂层所致,喷射后亮点的光谱与细胞或图像背景光谱不同。约40小时培养后,将再培养的细胞转移到培养管中,带有喷射细胞的培养基变浑浊,表明细胞生长成功,而对照组培养基保持清澈。对于GFP标记的大肠杆菌,收集器由薄琼脂层(约60μm)和标准盖玻片组成,便于观察收集器中的分选细胞。喷射前后的图像,喷射后收集器中GFP标记的大肠杆菌的宽场荧光图像证实大多数细胞保持良好状态。

四、从细胞混合物中筛选富含脂质的红冬孢酵母并鉴定
为展示S-RACE平台从混合物中筛选目标细胞的效用,我们测试从与酿酒酵母混合的细胞中筛选富含脂质的红冬孢酵母。红冬孢酵母是一种油脂酵母,其干重生物质中脂质含量可达70%,而酿酒酵母生物质中脂质含量仅约6%,富含脂质的酵母是可持续生物燃料生产的有价值模型。
利用多色SRS,可量化单个酵母细胞中的脂质含量,SRS图像中富含脂质的细胞内聚集体光谱与甘油三油酸酯相似,细胞体部分光谱与标准蛋白质样品蛋白胨相似,背景扣除后的脂质通道表明2851cm⁻¹处的SRS信号由脂质贡献。红冬孢酵母和酿酒酵母混合物的五色SRS图像光谱总和,随后从脂质通道识别富含脂质的细胞。使用配置(40×物镜)对细胞进行分选,分选富含脂质的细胞后,脂质通道强度显著降低,证实了富含脂质细胞的成功喷射。分选后的细胞由定制的由盖玻片和PDMS制成的收集器收集,进行四次独立试验,每个收集孔接收8-12个SRS视野的分选细胞。
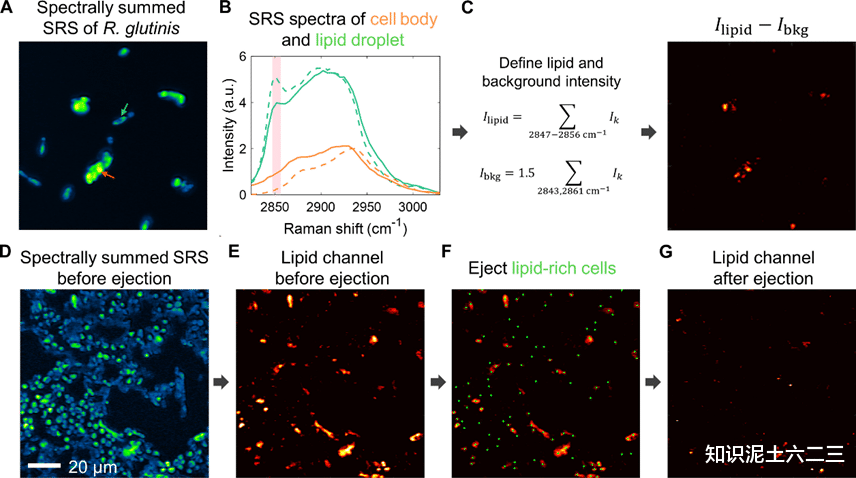
喷射产量为93.6±2.1%,纯度为79.6±0.8%,通量为12.6±2.9次喷射/秒,由于物体密度较高,纯度与无邻居排除标准的1.0μm聚合物微珠结果相似。

为确认分选细胞的身份与目标红冬孢酵母匹配,我们对收集的细胞进行qPCR。以核核糖体DNA中的ITS2作为目标序列,qPCR扩增制备的工作流程:DNA提取后,含有重悬DNA的上清液用于qPCR,使用先前研究中的引物。每个孔在qPCR扩增中产生三个重复,每个重复包含该孔总DNA含量的约16%。

收集细胞内容物的扩增在熔解曲线中呈现约81.3°C的峰,与红冬孢酵母纯培养的扩增结果一致,无模糊峰。需要注意的是,由于转移过程中的细胞损失以及较大细胞需要多次喷射,qPCR估计的每孔细胞数低于喷射次数。总之,这些结果表明S-RACE成功根据细胞表型/功能分选了特定细胞群。

五、S-RACE结合光控实现实时分选
将实时精密光控(RPOC)系统与S-RACE平台无缝集成,产生了一种实时细胞分选方法。RPOC利用闭环反馈控制电路进行激光操作,响应时间亚微秒级(55,56),使得成像-识别-分选能在激光扫描的单个像素内发生,为更高精度和效率带来机会。实时成像-分选的概念和比较器电路的前面板。

在激光扫描期间,携带样品化学信息的SRS信号被发送到比较器电路,对于高于预设阈值的SRS信号,比较器电路命令AOM快速耦合532nm激光,随后喷射当前像素中的目标物体。由于532nm激光重复率(16.6kHz)限制,采用70μs停留时间。为展示这种实时成像-分选机制的效用,基于SRS图像对1.0μm聚合物微珠、单细胞和组织切片进行分选。
对于聚合物微珠,通过阈值化SRS图像设置活动像素,每个聚合物微珠包含4-6个活动像素以获得最佳分选性能,大多数聚合物微珠根据其SRS强度成功分选。

对于活酿酒酵母,实时成像-分选前后的SRS图像,约48小时后,在带有分选细胞的培养皿中观察到六个酿酒酵母菌落,而对照组无菌落生长。

我们进一步测试了S-RACE对组织切片的适用性。制备冷冻切片的大鼠脑组织,基于2850cm⁻¹和2940cm⁻¹处的SRS图像消融多个ROI,2850和2940cm⁻¹附近的拉曼带分别代表细胞脂质和蛋白质,为冷冻切片组织提供分子特征和形态特征对比。
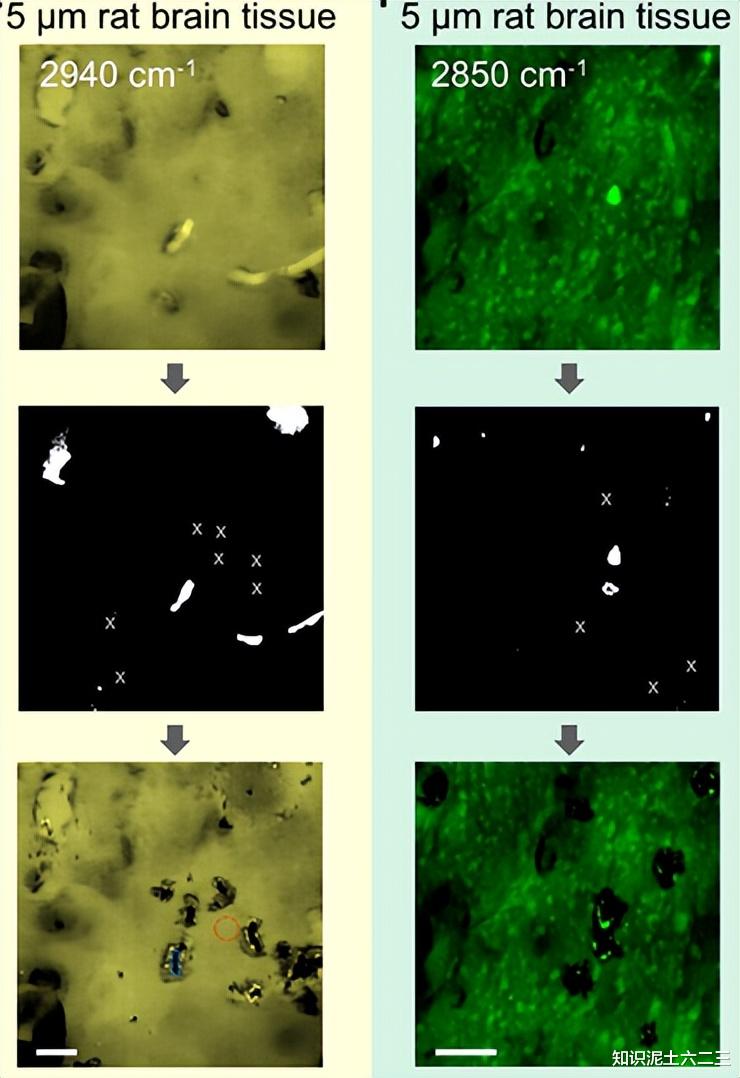
SRS光谱证实了成功的组织微切割,喷射点显示相对较低强度,未受影响区域显示典型的富含蛋白质的拉曼光谱。未来,借助两个比较器电路,可将脂质和蛋白质对比度相结合,用于组织微切割,而不是单色彩色SRS。

除大鼠脑组织外,我们还测试了骨癌组织切片,对三个视野成像,呈现富含蛋白质、血管和富含胶原蛋白的区域,手动选择喷射目标,喷射后的SRS光谱证实了成功喷射,还量化了喷射点的大小,富含蛋白质的骨癌组织喷射点大小为10.98±2.24μm,骨癌组织富含胶原蛋白区域的喷射尺寸较小,可能是因为胶原蛋白比富含蛋白质区域刚性更高。这些结果突显了S-RACE作为一种综合工具在从单细胞到组织切片的各种样品的空间多组学测量中的潜力。

六、一起来做做题吧
1、在 S - RACE 系统中,用于推动目标微粒或细胞离开的能量来源主要是( )
A. 532nm 脉冲激光作用于 TiO₂涂层产生的能量转变
B. 多光谱 SRS 显微镜的激光能量直接推动
C. 样品自身内部产生的能量反应
D. 收集器上 PDMS 涂层吸收激光能量后提供
2、使用聚合物微珠混合物测试 S - RACE 性能时,以下关于微珠分类和分选结果的说法正确的是( )
A. 所有微珠在分选前无法通过 SRS 图像进行分类
B. 分选后 PS 微珠的收集率达到了 100%
C. 提高微珠排除标准一定会降低分选产量
D. 严格的微珠排除标准有助于提高分选纯度
3、在对活细胞进行 S - RACE 操作时,为保护细胞采取的措施不包括( )
A. 在 TiO₂涂层上添加琼脂糖层
B. 控制激光辐射强度在安全范围内
C. 提高激光脉冲频率以缩短操作时间
D. 在收集器底部引入互补的琼脂糖层
4、在筛选富含脂质的红冬孢酵母实验中,用于确认分选细胞身份的方法是( )
A. 仅通过观察细胞在 SRS 图像中的形态
B. 测量分选后细胞的脂质含量
C. 对收集细胞进行 qPCR 扩增分析
D. 对比分选前后细胞的运动速度
5、S - RACE 结合光控实现实时分选时,比较器电路的主要作用是( )
A. 控制激光的波长和能量
B. 根据 SRS 信号阈值决定是否发射 532nm 激光进行分选
C. 调整样品台移动速度和方向
D. 增强 SRS 显微镜的成像分辨率
参考文献:
Jing Zhang et al. High-throughput single-cell sorting by stimulated Raman-activated cell ejection. Sci. Adv.10, eadn6373(2024).