转自:生物谷
2025年,全球mRNA疫苗累计接种已超百亿剂次,其高效性与安全性彻底改写了传染病防控的格局。从新冠疫苗到癌症治疗,mRNA技术正以惊人的速度渗透医学领域。然而,回溯至2005年,科学家Karikó团队首次发现,将mRNA中的尿苷(U)替换为假尿苷(Ψ),可显著降低免疫原性,这一发现成为mRNA疗法的“阿基米德支点”。但为何Ψ-RNA能逃避免疫系统的安检?
免疫系统中的Toll样受体7/8(TLR7/8)如同“核酸探测器”,其能专门识别病毒RNA降解产物从而触发炎症反应。而人体自身RNA因含Ψ等修饰,却能“蒙混过关”。这一现象不仅能解释mRNA疫苗的低免疫原性,更揭示了生命进化中自我-非我识别的精妙机制。
近日,一篇发表在国际杂志Cell上题为“PseudouridineRNAavoidsimmunedetectionthroughimpairedendolysosomalprocessingandTLRengagement”的研究报告中,来自慕尼黑大学等机构的科学家们通过研究首次发现,Ψ-RNA的“隐身术”源于溶酶体核酸酶RNaseT2和PLD外切酶的“选择性失明”以及TLR7/8受体的“双重忽视”。

mRNA疗法的成功依赖于Ψ修饰的免疫沉默特性,但其分子机制长期成谜。这项研究中,研究人员旨在揭示Ψ-RNA如何通过溶酶体加工和TLR识别双重关卡实现免疫逃逸,从而为设计更安全的RNA药物提供一定的理论依据。
文章中,研究人员采用体外转录的Ψ-RNA、m1Ψ-RNA(N1-甲基假尿苷)及未修饰RNA作为模型,并结合人源单核细胞、树突状细胞及TLR8/7基因敲除细胞系,系统评估免疫激活差异。研究中所用的关键试剂包括RNaseT2、PLD3/4外切酶及TLR特异性抑制剂(如CU-CPT9a)。
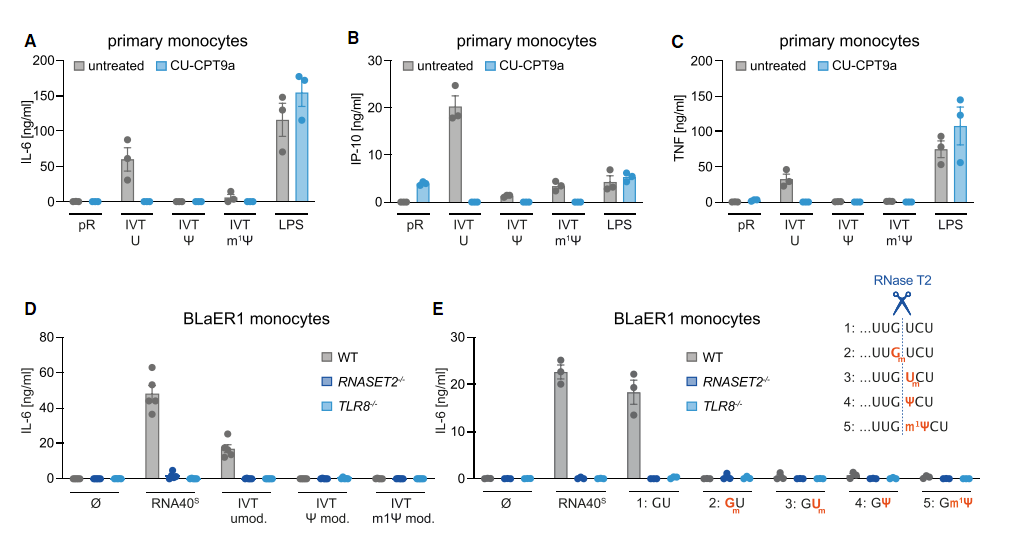
研究发现,RNaseT2对Ψ-RNA的切割效率较未修饰RNA下降超90%,且PLD外切酶同样难以降解Ψ-RNA。在细胞模型中,Ψ-RNA几乎无法激活TLR7/8依赖的炎症因子(如IL-6、IFN-α),而m1Ψ-RNA虽能微弱激活TLR8,但仍显著弱于未修饰RNA。
进一步通过核磁共振(NMR)研究发现,Ψ-RNA倾向于形成A型螺旋构象,从而就会导致RNaseT2的B2结合口袋无法适配,同时Ψ的N1位甲基化回进一步阻碍PLD外切酶的结合。
Ψ-RNA的免疫沉默并非单一机制,而是双保险。一方面,RNaseT2和PLD外切酶无法有效切割Ψ-RNA,从而导致TLR7/8配体生成受阻;另一方面,TLR8的第一结合口袋忽视Ψ,TLR7的第二结合口袋则拒绝Ψ-RNA片段。
这项研究中,研究人员首次系统揭示了Ψ-RNA免疫逃逸的分子细节,其意义远超mRNA疫苗领域。Ψ修饰可能是真核生物进化出的自我标记,其能通过干扰核酸酶和TLR的识别从而避免自身免疫攻击。这一发现不仅巩固了mRNA疗法的基石,更为RNA药物设计提供了“精准调控免疫原性”的新思路。
m1Ψ虽保留了部分TLR8激活能力,但其免疫原性仍远低于未修饰RNA,这就提示,未来RNA药物或能通过微调修饰位点的平衡疗效与安全性。LC-MS与NMR联用则为RNA修饰研究提供了高分辨率工具,未来或有望解析更多免疫隐身修饰(如2'-O-甲基化)的机制。
正如研究人员所言:“理解Ψ-RNA如何骗过免疫系统就像破解了RNA世界的“隐身斗篷”,下一次疫苗革命或许就藏在下一个Ψ里。”
参考文献:
MarleenBérouti,MirkoWagner,WilhelmGreulich,etal.PseudouridineRNAavoidsimmunedetectionthroughimpairedendolysosomalprocessingandTLRengagement,Cell(2025).DOI:10.1016/j.cell.2025.05.032
(转自:生物谷)