
盘点NSCLC领域TROP2靶向ADC药物在机制和临床获益方面的异同点。
ADC药物是近年来抗肿瘤精准治疗的热点探索方向,在肺癌领域已经表现出令人鼓舞的治疗前景。目前肺癌领域ADC药物的研发靶点主要集中在HER2、TROP2、HER3等。其中HER2靶向ADC药物德曲妥珠单抗(DS-8201/T-DXd)在肺癌领域ADC药物研发赛道脱颖而出,成为目前首个且唯一FDA获批HER2突变非小细胞肺癌(NSCLC)适应症的靶向疗法,开启了肺癌领域ADC药物治疗的新时代。TROP2靶向ADC药物也已崭露锋芒,包括Datopotamab deruxtecan(DS-1062/Dato-DXd)、Sacituzumab govitecan(SG)、SKB264均已开展III期临床试验,其中Dato-DXd更是率先披露III期研究阳性结果,有望引领First-in-class TROP2靶向ADC药物研发赛道。本文将聚焦TROP2靶向ADC药物,并从作用机制、临床研究进展等角度深入剖析Dato-DXd、SG、SKB264的异同点,以供领域学者参考。凭借精巧的药学设计,Dato-DXd在TROP2靶向ADC药物研发赛道脱颖而出
TROP2是一种细胞表面糖蛋白,在肿瘤细胞自我更新、增殖、入侵和转化中发挥着重要作用。TROP2在正常组织中低表达或不表达,但在多种肿瘤(如肺癌、胰腺癌、结肠癌和乳腺癌等)中高表达。在NSCLC中已发现TROP2高表达于38%-64%的腺癌[1]和35%-75%的鳞状细胞癌[2]。目前TROP2已经成为肺癌领域ADC药物研发的重要靶点。诸如Dato-DXd、SG、SKB264等TROP2靶向ADC药物则走在了该赛道的前列。 TROP2靶向ADC药物均由TROP2靶向单克隆抗体和高活性载荷通过特异性连接子偶联而成,能与表达TROP2的肿瘤细胞特异性结合,并在受体介导的内吞作用下进入肿瘤细胞,进而释放载荷,起到抗肿瘤杀伤作用。虽然同为TROP2靶向ADC药物,但在结构组成和作用机制方面,不同ADC药物存在一些差异[3]。表1. Dato-DXd、SG、SKB264的药物属性概况

NSCLC领域TROP2靶向ADC药物同台竞技,Dato-DXd或能拔得头筹
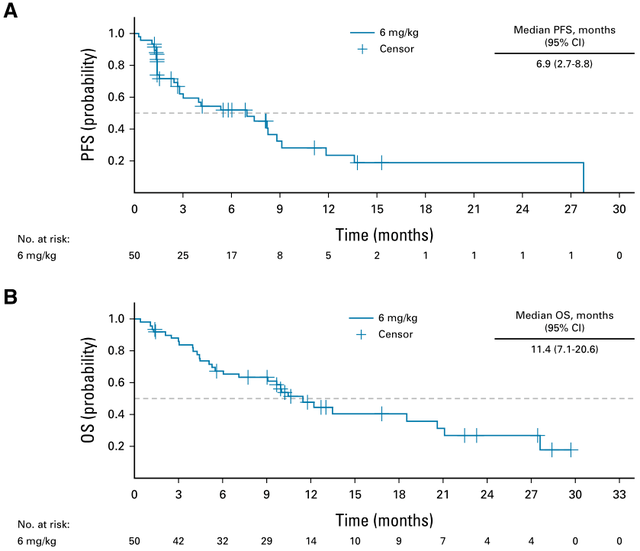
对于晚期NSCLC患者,尽管靶向治疗和免疫治疗显著改善了患者预后,但仍有部分患者无法从中获益;即便是获得最初的疗效,也不可避免发生耐药。而诸如Dato-DXd、SG、SKB264等TROP2靶向ADC药物在晚期NSCLC中展开了积极探索,有望打破这一临床困局。1Dato-DXd兼顾疗效和安全性,多项研究探索共同佐证其在晚期NSCLC中的治疗前景1.TROPION-PanTumor01研究初步验证Dato-DXd的临床获益,为后续探索夯实循证基础TROPION-PanTumor01是Dato-DXd的首个人体研究,这项多中心、开放标签、两阶段、(剂量递增和剂量扩展)Ⅰ期临床试验旨在评估Dato-DXd在包括NSCLC在内的多个实体瘤队列中的安全性、耐受性和抗肿瘤活性。既往NSCLC队列研究数据已多次亮相于各大国际学术大会,并且在2023年6月,该研究结果全文发表于《临床肿瘤学杂志》(Journal of Clinical Oncology,影响因子50.717)。 最新研究数据显示[4],在剂量扩展阶段,共纳入180例经标准治疗后复发/进展(或没有标准治疗可用)的晚期/转移性NSCLC患者伴或不伴有可靶向基因组改变(AGA),其中伴有AGA患者为35例,包括30例携带EGFR突变(15例为19号外显子缺失,12例为T790M突变,3例为20号外显子插入),3例携带ALK融合,1例携带ROS1融合,1例携带RET融合。入组患者分别接受4、6、8 mg/kg Dato-DXd治疗,患者的中位既往治疗线数为3。三个剂量组均观察到抗肿瘤活性,确认的客观缓解率(ORR)分别为22%、26%、23.8%,疾病控制率(DCR)分别为76.0%、70.0%、78.8%,中位缓解持续时间(DOR)分别为12.7个月、10.5个月、9.6个月,中位无进展生存(PFS)分别为4.3个月、6.9个月、5.2个月,中位总生存期(OS)分别为12.9个月、11.4个月、10.5个月。同时,无论TROP2表达水平如何,患者对Dato-DXd治疗均有应答。并且基于这些研究数据,确定6 mg/kg为Dato-DXd在NSCLC领域中进一步研究或探索的推荐剂量。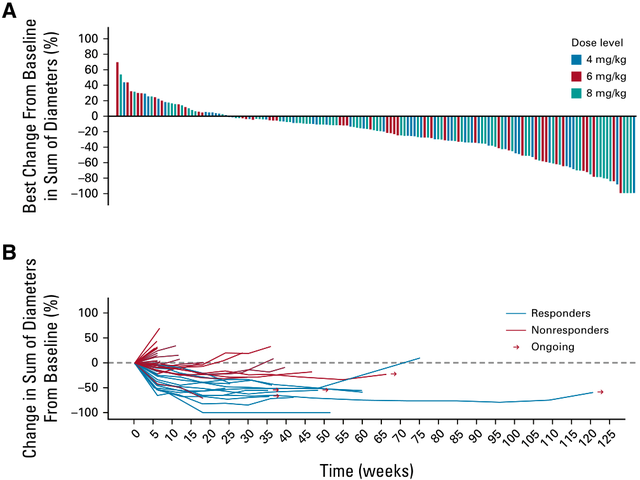
3.TROPION-Lung02研究证实Dato-DXd联合免疫检查点抑制剂±化疗的有效性,或为晚期NSCLC提供一线治疗新选择
TROPION-Lung02是一项正在进行的全球性、开放性、6队列、Ib期研究,旨在评估Dato-DXd(4或6 mg/kg)+帕博利珠单抗±铂类化疗(顺铂或卡铂)方案在初治或经治的无AGA晚期或转移性NSCLC患者的安全性和有效性。2023年美国临床肿瘤学会(ASCO)大会公布的结果显示[13],截至2023年4月7日,共有136例患者接受了治疗。在总人群中,双联组ORR为38%,三联组ORR为49%。两组DCR分别为84%和87%;中位PFS分别为8.3个月和7.8个月,但数据尚未成熟。亚组分析显示,一线治疗人群的疗效更为突出:双联组的ORR为50%,三联组的ORR为57%;两组的DCR均为91%,中位DoR均尚未达到。表2. 总人群和一线治疗人群的疗效数据
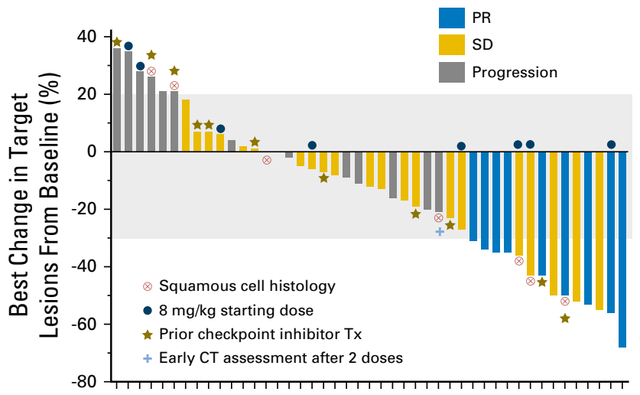

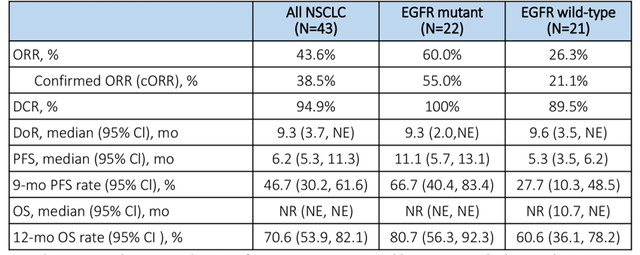
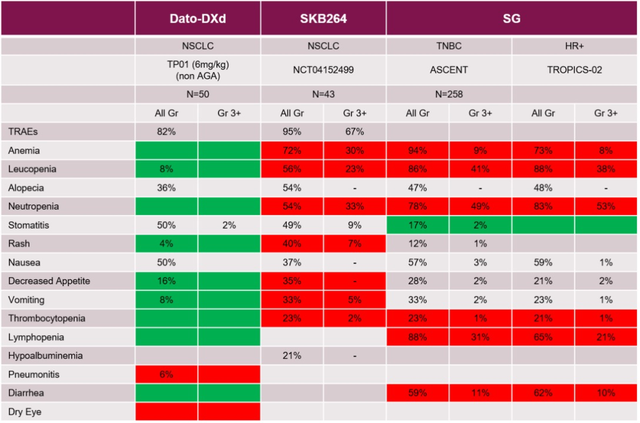
表4. Dato-DXd、SG、SKB264的不良反应发生概况(仅展示数据,非横向比较)
参考文献:
[1]Mito R, Matsubara E, Komohara Y, et al. Clinical impact of TROP2 in non-small lung cancers and its correlation with abnormal p53 nuclear accumulation. Pathol Int. 2020 May;70(5):287-294.
[2]Inamura K, Yokouchi Y, Kobayashi M, et al. Association of tumor TROP2 expression with prognosis varies among lung cancer subtypes. Oncotarget. 2017 Apr 25;8(17):28725-28735.
[3]李博乐,冯红蕾,魏枫,等.肿瘤抗体药物偶联物的研发进展和挑战[J].中国肿瘤临床, 2022, 49(16):8.
[4]Shimizu T, Sands J, Yoh K, et al. First-in-Human, Phase I Dose-Escalation and Dose-Expansion Study of Trophoblast Cell-Surface Antigen 2-Directed Antibody-Drug Conjugate Datopotamab Deruxtecan in Non-Small-Cell Lung Cancer: TROPION-PanTumor01[J]. J Clin Oncol. Published online June 16, 2023.
[5]Stepan LP, Trueblood ES, Hale K, et al. Expression of Trop2 cell surface glycoprotein in normal and tumor tissues: potential implications as a cancer therapeutic target. J Histochem Cytochem, 2011, 59(7):701-710.
[6]Liu X, Deng J, Yuan Y, et al. Advances in Trop2-targeted therapy: Novel agents and opportunities beyond breast cancer. Pharmacol Ther. 2022 Nov;239:108296.
[7]Bardia A, Hurvitz SA, Tolaney SM, et al. Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. N Engl J Med. 2021 Apr 22;384(16):1529-1541.
[8]Okajima D, Yasuda S, Maejima T, et al. Datopotamab Deruxtecan, a Novel TROP2-directed Antibody-drug Conjugate, Demonstrates Potent Antitumor Activity by Efficient Drug Delivery to Tumor Cells. Mol Cancer Ther. 2021 Dec;20(12):2329-2340.
[9]Cheng Y, Yuan X, Tian Q, et al. Preclinical profiles of SKB264, a novel anti-TROP2 antibody conjugated to topoisomerase inhibitor, demonstrated promising antitumor efficacy compared to IMMU-132. Front Oncol. 2022 Dec 23;12:951589.
[10]Nagai Y, Oitate M, Shiozawa H, et al. Comprehensive preclinical pharmacokinetic evaluations of trastuzumab deruxtecan (DS-8201a), a HER2-targeting antibody-drug conjugate, in cynomolgus monkeys. Xenobiotica. 2019 Sep;49(9):1086-1096.
[11]戈沙妥珠单抗说明书
[12]https://www.astrazeneca.com/media-centre/press-releases/2023/datopotamab-deruxtecan-met-dual-primary-endpoint-of-progression-free-survival-in-patients-with-advanced-non-small-cell-lung-cancer.html
[13]Goto Y, Su WC, Levy BP, et al. TROPION-Lung02: Datopotamab deruxtecan (Dato-DXd) plus pembrolizumab (pembro) with or without platinum chemotherapy (Pt-CT) in advanced non-small cell lung cancer (aNSCLC). 2023 ASCO. Abstract 9004.
[14]Heist RS, Guarino MJ, Masters G, et al. Therapy of Advanced Non-Small-Cell Lung Cancer With an SN-38-Anti-Trop-2 Drug Conjugate, Sacituzumab Govitecan. J Clin Oncol. 2017 Aug 20;35(24):2790-2797.
[15]Fang WF, Cheng Y, Chen ZD, et al. SKB264 (TROP2-ADC) for the treatment of patients with advanced NSCLC: Efficacy and safety data from a phase 2 study. 2023 ASCO. 9114.
* 此文仅用于向医学人士提供科学信息,不代表本平台观点
