转自:生物谷
在一项前沿研究中,马克斯-德尔布吕克中心科学主任MaikeSander领衔的团队成功开发出胰腺激素分泌细胞的血管化类器官模型,即具有血管网络的人诱导性多能干细胞衍生性胰岛(SC-islets)。
这一成果发表于《DevelopmentalCell》杂志,有望推动糖尿病研究与细胞疗法迈向新高度。

胰岛作为胰腺内分泌细胞团,包含胰岛素生成的β细胞等关键细胞类型。Sander实验室发现,与无血管类器官相比,新增血管网络的SC-islets类器官包含更多成熟β细胞,能分泌更多胰岛素,更精准地模拟人体内胰岛细胞环境。Sander强调:“我们的研究表明血管网络对维持胰岛细胞功能至关重要,该模型使我们更接近复制胰腺的自然微环境,对糖尿病研究和新疗法开发意义重大。”
血管化干细胞衍生性胰岛的构建
在构建血管化SC-islets类器官的过程中,研究团队在干细胞培育的胰岛类器官中添加了内皮细胞和成纤维细胞。经过对不同培养基配方的系统筛选,最终找到理想组合。这些细胞不仅存活下来,还发育出包裹并穿透SC-islets的管状血管网络。Sander说:“关键突破在于配方设计,我们跨学科团队历经五年测试各种培养条件才取得成功。”
实验对比发现,血管化胰岛类器官在高糖环境下分泌更多胰岛素,表明其含有更成熟的β细胞。研究进一步揭示,内皮细胞和成纤维细胞协同构建细胞外基质触发成熟信号,内皮细胞分泌的骨形态发生蛋白(BMP)直接促进β细胞成熟。此外,团队将类器官整合到微流控芯片中,使营养液流经血管网络,进一步提升了成熟β细胞比例。
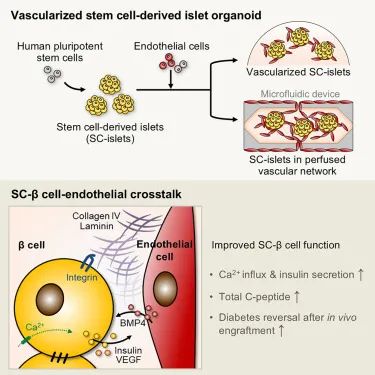
在体内实验中,移植血管化类器官的糖尿病小鼠治疗效果显著优于非血管化组,部分小鼠在移植19周后仍无疾病迹象,证实了血管化预处理可提升移植SC-islets功能。
Sander计划利用这种类器官模型深度研究1型糖尿病,培育源自患者细胞的血管化类器官并植入微流控芯片后加入患者免疫细胞,旨在揭示免疫细胞如何摧毁β细胞,助力未来疗法开发。
这一创新突破不仅为糖尿病研究者提供了更优质的研究模型,也为糖尿病治疗开辟了新的治疗途径,有望为全球数亿糖尿病患者带来福音。
参考文献:
YeslJunetal,Engineeredvasculatureinducesfunctionalmaturationofpluripotentstemcell-derivedisletorganoids,DevelopmentalCell(2025).DOI:10.1016/j.devcel.2025.04.024.
(转自:生物谷)