
引言
细胞内环境的pH直接影响生化反应的速率与平衡,pH稳态的失衡将会引起细胞内生物大分子功能紊乱,从而引发细胞状态异常并导致疾病。可兴奋细胞包括视觉成像细胞、心肌细胞、神经元等,是一类代谢活动相对旺盛的细胞。可兴奋细胞工作过程中产生的大量代谢物分子(如碳酸氢根)对细胞内pH稳态具有扰动作用,容易引起细胞质的碱化从而影响其正常生理功能。为应对这一问题,可兴奋细胞表面表达多种转运体和通道蛋白负责pH稳态的维持,它们通过改变膜两侧的氢离子浓度和各种酸根浓度来灵活地调节细胞内的pH。这些pH调节蛋白中,3型阴离子交换体蛋白(anion exchanger 3, AE3)发挥着重要作用(图1)。人类AE3由SLC4A3基因编码,属于溶质转运体SLC4家族。该家族包括三种阴离子交换体蛋白,分别为AE1-3。AE1在红细胞中高水平表达,通过将碳酸氢根释放入血液来辅助红细胞输送二氧化碳的功能。AE2广泛表达于多种组织,其在泌酸性细胞中(如破骨细胞或胃壁细胞)通过催化碳酸氢根与氯离子的交换来维持泌酸性细胞的pH稳态。这两个成员的结构目前已先后获得高分辨率解析。然而,在可兴奋细胞中发挥pH稳态维持作用的AE3的结构仍未解析,它与AE1/2在pH相应、抑制剂敏感性等分子行为上的差异目前无法得到合理的解释。
 图1:AE2和AE3分别通过催化碳酸氢根与氯离子的内外交换来调节泌酸性细胞和可兴奋细胞的pH稳态。(Credit: Nature Communications)SLC4A3基因上发生的突变可通过干扰AE3功能而造成多种病理性后果。在人体中,SLC4A3的多个突变被发现与短QT综合征高度关联,其所编码的突变体AE3在pH稳态维持功能上的缺陷可引起心肌细胞内pH异常增高与氯离子水平降低,继而引发心脏功能疾病【1】。除此之外,AE3的功能性突变还与癫痫相关联,其活性降低导致的细胞内pH升高是造成神经元超兴奋性的元凶【2】。在小鼠和其它实验动物中,AE3的功能失调还被发现可导致视网膜病变等视觉疾病【3】。因此,解析AE3的结构不仅可以帮助了解阴离子跨膜运输生物过程的分子机制,同样也有助于探索可兴奋性细胞病变相关疾病的分子病理。2024年7月20日,上海交通大学医学院附属第九人民医院精准医学研究院的曹禹团队联合眼科李琳团队与骨科秦安团队在Nature Communications上发表题为The structural insight into the functional modulation of human anion exchanger 3 (人类3型阴离子交换体蛋白功能调节的结构探索)的研究论文,首次解析了人类3型阴离子交换体蛋白的冷冻电镜结构,为AE家族在pH响应性和抑制剂敏感性上的差异提供了结构基础,并进一步揭示了致病性突变造成AE3功能异常的原因。
图1:AE2和AE3分别通过催化碳酸氢根与氯离子的内外交换来调节泌酸性细胞和可兴奋细胞的pH稳态。(Credit: Nature Communications)SLC4A3基因上发生的突变可通过干扰AE3功能而造成多种病理性后果。在人体中,SLC4A3的多个突变被发现与短QT综合征高度关联,其所编码的突变体AE3在pH稳态维持功能上的缺陷可引起心肌细胞内pH异常增高与氯离子水平降低,继而引发心脏功能疾病【1】。除此之外,AE3的功能性突变还与癫痫相关联,其活性降低导致的细胞内pH升高是造成神经元超兴奋性的元凶【2】。在小鼠和其它实验动物中,AE3的功能失调还被发现可导致视网膜病变等视觉疾病【3】。因此,解析AE3的结构不仅可以帮助了解阴离子跨膜运输生物过程的分子机制,同样也有助于探索可兴奋性细胞病变相关疾病的分子病理。2024年7月20日,上海交通大学医学院附属第九人民医院精准医学研究院的曹禹团队联合眼科李琳团队与骨科秦安团队在Nature Communications上发表题为The structural insight into the functional modulation of human anion exchanger 3 (人类3型阴离子交换体蛋白功能调节的结构探索)的研究论文,首次解析了人类3型阴离子交换体蛋白的冷冻电镜结构,为AE家族在pH响应性和抑制剂敏感性上的差异提供了结构基础,并进一步揭示了致病性突变造成AE3功能异常的原因。
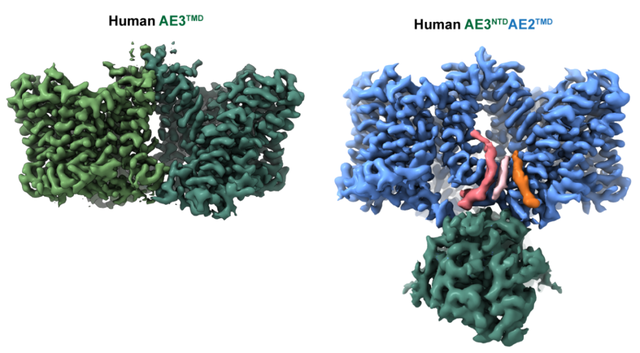

图3:人类AE家族三个成员与抑制剂分子DIDS形成复合物的局部结构差异细节。(Credit: Nature Communications)
AE家族的另一个特点是均具有一个较大体积的N末端胞内结构域(NTD),这一结构域与跨膜区域(TMD)之间的连接柔性较大,使得AE家族的全长结构获得殊非易事。与AE2相比,AE3的NTD-TMD连接柔性更大,并且TMD长期稳定于较不利于全长结构解析的外向开放构象,这造成了AE3全长结构的解析困难。为获得AE3 NTD的结构信息,该论文利用AE2的TMD处于内向开放构象的稳定性,通过构建AE3 NTD与AE2 TMD的嵌合型转运蛋白并解析其全长结构,实现了对AE3 NTD结构的测定(图2),并结合基于同源性的模型计算方式,搭建了全长AE3结构的理论模型。基于上述模型的获得,本研究还分析了多种致病突变的位置,在结构上揭示了相关疾病发生的分子病理(图4)。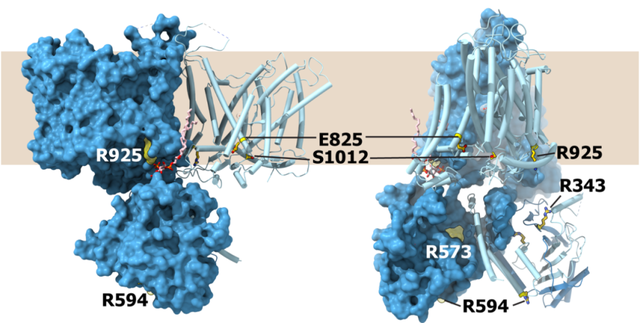
参考文献
[1] Thorsen K, Dam VS, Kjaer-Sorensen K, Pedersen LN, Skeberdis VA, Jurevicius J, Treinys R, Petersen I, Nielsen MS, Oxvig C, Morth JP, Matchkov VV, Aalkjaer C, Bundgaard H, Jensen HK. Loss-of-activity-mutation in the cardiac chloride-bicarbonate exchanger ae3 causes short qt syndrome. Nat Commun, 2017, 8: 1696[2] Sander T, Toliat MR, Heils A, Leschik G, Becker C, Ruschendorf F, Rohde K, Mundlos S, Nurnberg P. Association of the 867asp variant of the human anion exchanger 3 gene with common subtypes of idiopathic generalized epilepsy. Epilepsy Res, 2002, 51: 249-255[3] Alvarez BV, Gilmour GS, Mema SC, Martin BT, Shull GE, Casey JR, Sauve Y. Blindness caused by deficiency in ae3 chloride/bicarbonate exchanger. PLoS One, 2007, 2: e839[4] Zhang Q, Jian L, Yao D, Rao B, Xia Y, Hu K, Li S, Shen Y, Cao M, Qin A, Zhao J, Cao Y. The structural basis of the pH-homeostasis mediated by the Cl-/HCO3- exchanger, AE2. Nat Commun, 2023, 14: 1812https://www.nature.com/articles/s41467-024-50572-x责编|探索君
排版|探索君
文章来源|“BioArt”
End