*仅供医学专业人士阅读参考
点击右上方“关注”,准时接收每日精彩内容推送。
生物3D打印是一种很有前途的技术,可为组织工程制造定制几何形状。然而,大多数可生物打印水凝胶都很脆弱,难以处理,并且无法模仿天然软弹性组织的机械行为。
基于此,来自美国东北大学的Guohao Dai/美国德克萨斯大学的Yi Hong团队开发了一种基于聚乙二醇(PEG)和聚己内酯(PCL)的丙烯酸酯三嵌段共聚物(PEG-PCL-DA)的可见光交联、单网络、弹性和生物相容性水凝胶系统。相关研究成果以“3D Bioprinting Highly Elastic PEG-PCL-DA Hydrogel for Soft Tissue Fabrication and Biomechanical Stimulation”为题于2024年3月13日发表在《Advanced Functional Materials》上。
1. 水凝胶的基本性能
作者首先评估了添加和不添加α-CD的PEG-PCL-DA前体溶液的粘度。在不添加α-CD的情况下,PEG-PCL-DA前体的粘度随着剪切速率的增加而保持恒定(<1 Pa•s),表明牛顿流体行为。然而,随着α-CD的添加,PEG-PCL-DA/α-CD前体的粘度在低剪切速率下升高,并随着剪切速率的增加而降低,表现出剪切稀化特性(图1A)。在将下一层沉积在生物墨水之上之前,生物墨水必须恢复其承载特性。因此,其力学性能的恢复率和百分比是重要的设计标准。作者通过动态改变流变仪的转速(剪切速率)来评估这一特性,并测量相应的粘度变化(图1B)。经研究表明3% w/v α-CD配方可能会产生高保真度打印,从而产生更高分辨率的细丝。此外,水凝胶的屈服应力随着α-CD浓度的增加而增加。PEG-PCL-DA/α-CD(2%和3%)的屈服应力分别为41±2和238±14 Pa(图1E)。作为参考,商业生物打印材料Cellink START 的屈服应力约为217 Pa,表明该水凝胶材料具有优异的可打印性。

图1 水凝胶的基本性能分析
2. 适印性评估
生物墨水的流变学表明该配方适合3D打印,然后作者通过生物墨水的实际打印来进行测试。PEG-PCL-DA的印刷适性随着不同α-CD浓度的增加而提高。随着α-CD浓度的增加,细丝的清晰度增加,表明分辨率提高(图2A)。增加的打印间距将减少细丝彼此混合的影响,从而提高最终结构的打印分辨率(图2B)。为了评估3D打印适性,作者使用SolidWorks设计了一个45°倾斜角的金字塔结构。含有3% α-CD的溶液产生更锐利的角度和明确的细丝。所得金字塔的倾斜角更准确,为43.1°。这些结果证实了流变数据的预测。

图2 水凝胶的适印性
3. 生物打印后细胞活力
为了评估生物墨水是否适合活细胞水凝胶结构的生物打印,作者评估了打印后的细胞活力。2% α-CD生物墨水的生存能力约为 90%,而3% α-CD生物墨水的生存能力约为70%(图3A、B)。观察到的细胞活力较低可能是由于生物打印过程中对细胞施加的剪切应力较高。为了证明材料打印复杂特征的能力,作者打印了分叉血管导管,这是一种使用传统组织工程方法难以制造的结构。该打印选择含有10% PEG-PCL-DA / 2.5% α-CD的生物墨水,作为分辨率和细胞活力之间的折衷方案。由此产生的含有成纤维细胞的分叉血管在打印后7天后仍保持活力(图3C)。
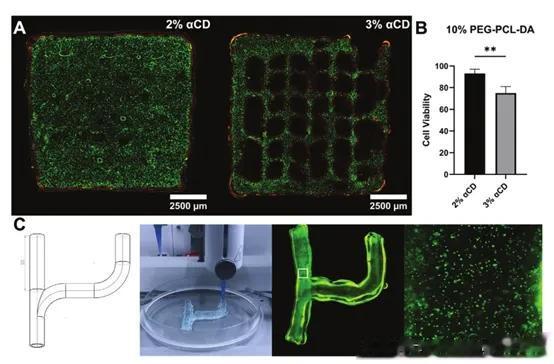
图3 生物打印后的细胞活力评估
4. VPMS肽对包膜成纤维细胞形态的影响
PEG-PCL-DA水凝胶具有遗传惰性,因此不能支持细胞扩散和组织重塑。为了使这种特性能够用于未来的组织工程应用,通过掺入生物活性肽:RGD和MMP可裂解肽VPMS来修饰水凝胶。硫醇化肽的硫醇基团在交联步骤中会与PEG-DA或PEG-PCL-DA的双键反应形成凝胶。图4A表明,可以通过改变制剂中VPMS肽的浓度来调节3D环境中成纤维细胞的扩散程度。在没有VMPS肽的情况下,细胞呈现圆形形态,无法有效扩散或重塑,即使存在RGD粘附肽也是如此。在含有2 mm VMPS肽的水凝胶中,成纤维细胞表现出互连细胞网络的形成。这凸显了MMP敏感肽在允许细胞间接触的建立条件中的重要性。
随后,作者系统地探讨了4-APA浓度对水凝胶基质内细胞行为的影响,评估了含有不同浓度4-APA的水凝胶制剂对细胞形态和扩散的影响(图4B)。总的来说,将4-APA纳入水凝胶系统不仅提高了其结构稳定性,而且证明了其在促进受控细胞行为方面的多功能性,为其在组织工程和再生医学中的应用铺平了道路。
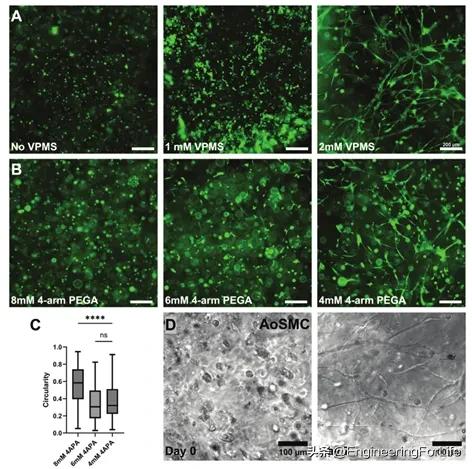
图4 成纤维细胞形态变化
5. 支架弹性对脉动周向应变的影响
为了证明弹性水凝胶可以支持细胞的生物力学训练,研究了生物反应器内弹性PEG-PCL-DA和非弹性PEG-DA导管在脉动压力下的拉伸和反冲行为(图5A)。作者将PEG-DA导管小心地组装到生物反应器中,并对其施加脉动压力。非弹性PEG-DA导管在暴露于脉动压力时表现出膨胀效应。另一方面,PEG-PCL-DA导管表现出有效拉伸和反冲至基线水平的能力,适应脉动压力施加的周期性机械力(图5B)。此外,即使在2和3 Hz脉冲频率下,弹性PEG-PCL-DA导管始终表现出其与脉动压力同步拉伸和反冲的能力(图5B),充分说明了弹性导管卓越的机械转换效率,展示了它们熟练地将循环机械力转化为对嵌入细胞有意义的机械线索的能力。

图5 脉动流生物反应器设置及不同脉冲频率脉动流下血管的循环应变
6. 脉动压力下支架弹性对VSMC表型的影响
然后,作者评估了嵌入水凝胶内的血管平滑肌细胞(VSMC)对脉动压力刺激的反应。培养7天后,对暴露于脉动压力调节的血管进行分析,并与静态培养下的血管进行比较(图6)。接种在弹性PEG-PCL-DA导管中的VSMC表现出独特而强大的反应,核心转录因子和下游基因之间一致上调。这一结果可能归因于细胞恢复收缩功能的努力,表明对机械环境的动态响应。这些发现表明 PEG-PCL-DA水凝胶能够为SMC提供一致的循环拉伸和反冲,从而上调参与收缩表型的核心转录因子

图6 静态或脉冲培养7天后,PEGDA和PEG-PCL-DA血管中培养的VSMC的基因表达
7. 血管导管的免疫组织化学分析
为了验证基因表达研究的结果,采用免疫组织化学来可视化相应的蛋白质表达。对于PEG-DA凝胶,定量图像分析显示,在比较静态和脉动流条件时,SRF、MRTFA、CNN1和ACTA2的蛋白质表达水平没有明显差异(图7C)。相反,对于PEG-PCL-DA导管,静态条件下培养的VSMC和脉冲条件下培养的VSMC之间的蛋白质表达存在显着差异(图7A)。特别是,与静态对照相比,脉动条件下的细胞数量有所减少(图7B)。PEG-DA和PEG-PCL-DA条件下蛋白质表达的差异反应强调了支架弹性在调节细胞行为和分子途径中的重要性,进一步强调了血管平滑肌背景下机械信号和细胞反应之间复杂的相互作用细胞。

图7 血管的免疫组织化学染色
综上,本研究成功实现了三个主要目标:1)开发适用于3D生物打印的弹性水凝胶,2)通过粘附和MMP敏感肽的整合增强生物活性,3)展示这种能力弹性生物材料在脉动流条件下促进收缩SMC表型。这些发现对于进一步开发用于软组织3D生物打印的弹性水凝胶具有良好的意义,这些软组织可以进行生物力学训练和组织重塑。
了解更多
关注“EngineeringForLife”,了解更多前沿科研资讯