导语:本文通过深入的分子层面探索,揭示了腹部肥胖与代谢功能障碍相关性脂肪肝病之间的细胞类型特异性联系,不仅丰富了我们对肥胖相关疾病分子机制的认识,也为未来的精准医疗提供了新的视角和潜在的治疗靶点。
腹部肥胖是代谢功能障碍相关性脂肪肝病(MASLD)的重要危险因素之一,两者之间存在显著关联。尽管已有大量研究揭示了肥胖与多种常见疾病之间的联系,但腹部肥胖对MASLD影响的细胞类型特异性生物学机制仍不清晰。腹部脂肪的过度积累不仅引发了全身性炎性反应,还通过复杂的代谢途径影响肝脏脂肪沉积和功能障碍。然而,精确识别与肥胖相关的遗传变异,以及这些变异如何在细胞层面影响代谢功能,仍是当前研究的重大挑战。

2024年8月,EBioMedicine杂志发表了一篇题为“单核RNA测序集成风险变异共定位发现17个与腹部肥胖相关的细胞类型特异性基因,用于代谢功能障碍相关的脂肪肝病”的研究,发现了17个与腹部肥胖相关且在MASLD中具有细胞类型特异性的基因,为理解腹部肥胖如何通过特定细胞类型影响MASLD的发生和发展提供了新的线索,也为未来的精准治疗提供了潜在的靶点。
研究方法
本研究是一项多组学分析研究,旨在阐明腹部肥胖与MASLD之间的细胞类型水平的生物学机制。研究纳入了芬兰东部大学和库奥皮奥大学医院招募的肥胖患者(n=509),进行了为期一年的Kuopio肥胖手术研究(KOBS)。研究使用单核RNA测序(snRNA-seq)和大量顺式表达数量性状位点(eQTL)数据,结合英国生物银行的全基因组关联研究(GWAS)数据,采用共定位方法。研究的主要终点是识别与腹部肥胖相关的MASLD基因,次要终点包括基因表达模式和细胞类型特异性的表型。
研究结果
17个腹部肥胖相关基因的发现
通过单核RNA测序和遗传共定位分析的方法,研究人员识别了17个与腹部肥胖相关的基因。这些基因通过调控脂肪细胞类型标记基因的表达,与代谢功能障碍相关性脂肪肝病(MASLD)的发生发展密切相关(见图1)。这一发现为理解腹部肥胖与代谢功能障碍相关性脂肪肝病之间的分子联系提供了新的视角,并为开发针对性的治疗方法提供了潜在的分子靶点。
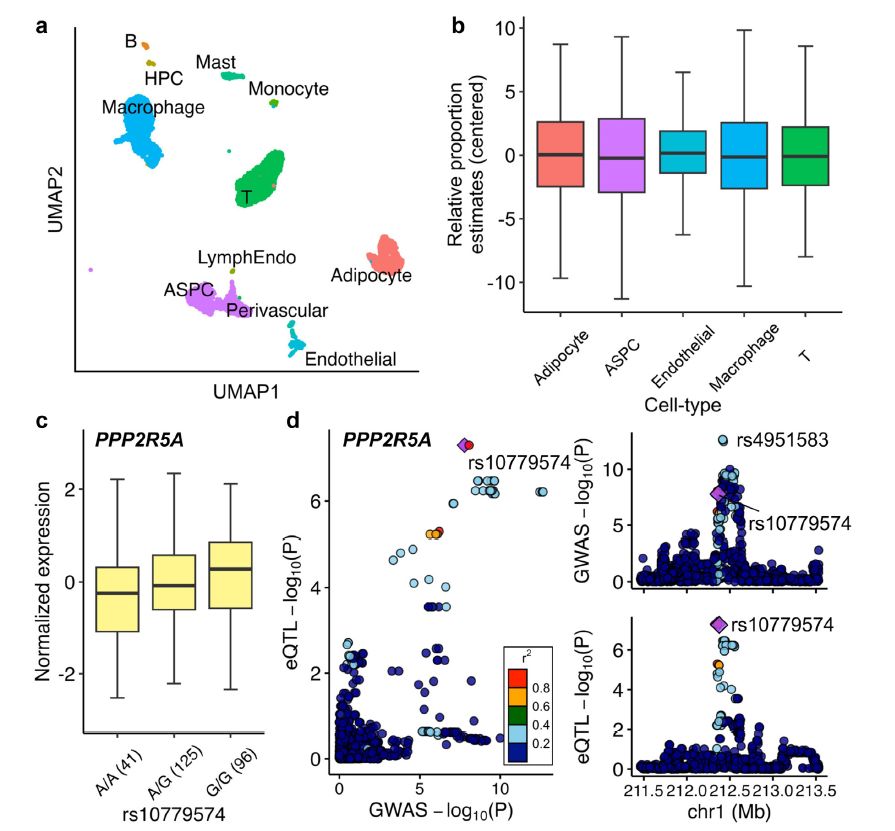
细胞类型特异性的因果效应
通过Mendelian Randomization (MR)分析,并以17个腹部肥胖GWAS变异作为工具变量,研究结果揭示了腹部肥胖对MASLD的细胞类型特异性因果效应(见图1)。这证实了腹部肥胖可通过影响特定脂肪细胞类型,进而影响肝脏健康,为理解肥胖与肝脏疾病之间的复杂关系提供了新的视角。
基因表达模式的确认
单细胞数据的分析进一步证实了这17个基因在脂肪细胞中的表达富集,结果表明,这些基因在脂肪细胞中发挥着重要作用。这一发现为理解脂肪细胞在肥胖相关疾病中的功能提供了重要的分子证据。
功能验证实验的突破
通过敲除PPP2R5A和SH3PXD2B两个基因,研究人员观察到脂肪细胞脂质积累显著减少,脂肪细胞功能和脂肪生成调节基因(如DGAT2、LPL、ADIPOQ、PPARG和SREBF1)的表达也发生了显著变化。这些结果不仅验证了这些基因在脂肪细胞发育和功能中的关键作用,也为开发针对这些基因的干预策略提供了理论基础。
MASLD表达特征的捕捉
研究发现,这17个基因在皮下脂肪组织中捕获了MASLD的表达特征,这一发现为MASLD的早期诊断和治疗提供了潜在的生物标志物。通过进一步研究这些基因在不同疾病状态下的表达变化,可能有助于开发更为精准的诊断工具和治疗方法。
多方法验证的一致性
通过多种MR方法(包括cML-MA-BIC、IVW、MR-PRESSO和加权中位数)的一致性验证,研究结果的可靠性得到了进一步的加强。这些方法的一致性结果表明,腹部肥胖对MASLD的影响是真实存在的,并且这种影响在不同的统计分析方法下均得到了验证(见图2)。

图2 使用多种MR方法证明WHRadjBMI对MASLD的假定因果效应
此外,通过使用MASLD GWAS变异作为工具变量进行MR分析,研究人员排除了MASLD对腹部肥胖的反向因果关系。这一结果进一步支持了腹部肥胖是MASLD发生的一个重要驱动因素。
总结
本研究采用单核RNA测序技术,结合细胞类型特异性的遗传变异分析,从而在细胞层面上揭示了腹部肥胖与MASLD之间的联系。这种细胞类型水平的研究为理解肥胖对肝脏疾病的影响提供了新的视角,并可能为开发针对特定细胞类型的治疗策略提供靶点。研究的结论不仅为MASLD的发病机制提供了新的见解,也为未来的治疗干预提供了潜在的分子靶标。
参考文献
LEE S H T, GARSKE K M, ARASU U T, et al. Single nucleus RNA-sequencing integrated into risk variant colocalization discovers 17 cell-type-specific abdominal obesity genes for metabolic dysfunction-associated steatotic liver disease[J]. EBioMedicine, 2024. DOI: 10.1016/j.ebiom.2024.105232
“医学论坛网”发布医学领域研究成果和解读,供专业人员科研参考,不作为诊疗标准,使用需根据具体情况评估。
编辑:连翘
二审:清扬
三审:碧泉
排版:半夏