【摘要】
疟疾是由感染恶性疟原虫的红细胞在微血管中积聚引起的。这一过程由寄生虫的PfEMP1粘附蛋白介导发生。某些特定的PfEMP1变体通过其CIDRα1结构域与人类受体EPCR结合,导致严重疟疾发病。一个长期以来未被解决的科学问题是否存在一个抗体能够识别出导致疟疾发生的大量的PfEMP1变体。
来自丹麦哥本哈根大学的Thomas Lavstsen和Louise Turner以及美国德克萨斯州圣安东尼奥市德克萨斯大学的Evelien M. Bunnik发现了两种对能够广泛反应并抑制CIDRα1的人类单克隆抗体。
这些抗体从两个不同个体中分离出来,对多种CIDRα1结构域都产生了EPCR结合抑制作用,这些结构域覆盖了CIDRα1六个亚类中的五个。
两种抗体都抑制了重组全长和天然PfEMP1蛋白的EPCR结合,以及在生理条件下生物工程3D人脑微血管中的寄生虫隔离。
对这两种抗体与三种不同的CIDRα1抗原变体的复合物进行结构分析,揭示了相似的结合机制,抗体通过与CIDRα1中EPCR结合位点的三个高度保守氨基酸残基相互作用发挥功能。
发现这些抗体可能意味着发现了对抗严重疟疾的获得性免疫机制,同时为设计针对严重疟疾的疫苗或治疗方法提供了新的见解。
【图文导读】
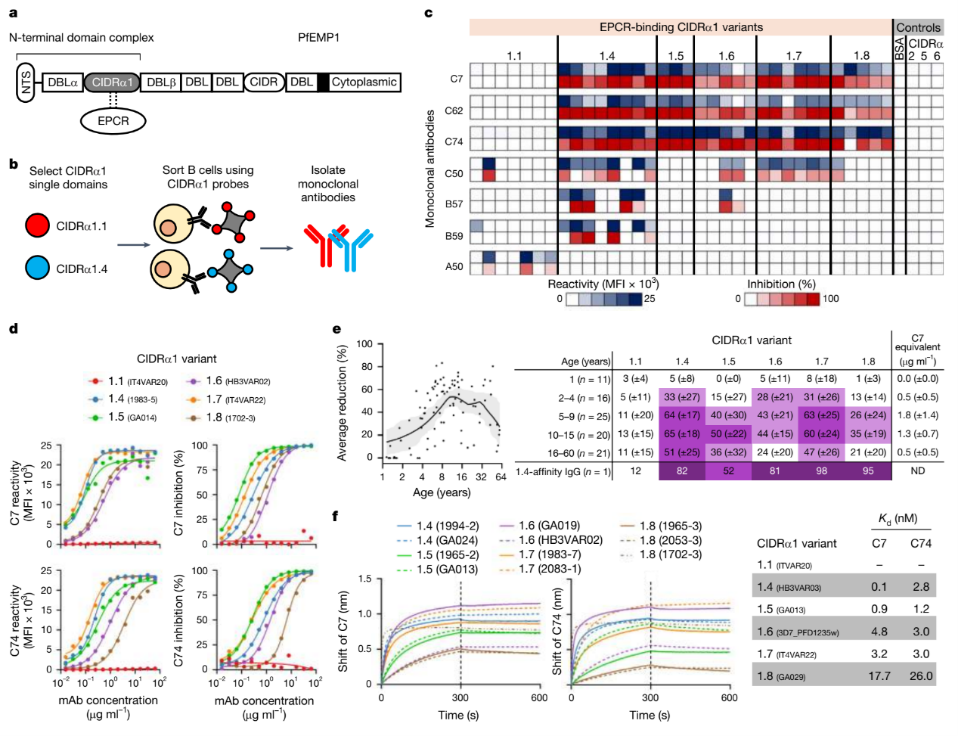
图1. 分离PfEMP1 CIDRα1结构域单克隆抗体

图2. C7和C74对恶性疟原虫感染红细胞的反应性和抑制作用

图3. C7 Fab与重组PfEMP1复合物的结构分析

图4. C74 Fab 与重组 CIDRα1 PfEMP1 变体复合的冷冻电镜(Cryo-EM)结构
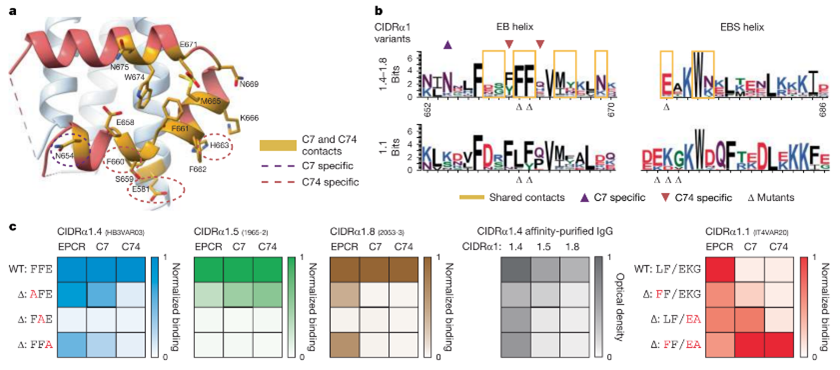
图5. C7和C74表位残基的保留和表面暴露
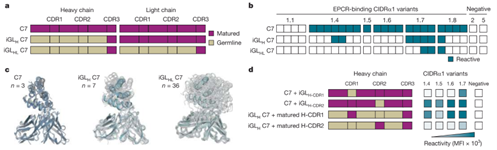
图6. C7种系单克隆抗体分析
本研究中,冷冻电镜发挥了巨大作用。文章中所有抗原抗体复合物结构,均使用冷冻电镜进行结构解析,进而确定其相互作用机理。冷冻电镜作为贡献巨大的结构生物学手段,能够直接解析大分子三维结构,而无需对样品进行结晶处理,为许多难结晶蛋白质的研究带来了新的希望。
「青云瑞晶」自拥有单晶X射线衍射(XRD)、冷冻电镜单颗粒法(CryoEM-SPA)、MicroED三种结构解析技术平台,根据蛋白质的不同性质,提供不同的jie决方案,结合精良高端的实验设备、经验丰富的高学历科研团队,为您提供从蛋白表达开始的一站式结构解析服务,灵活多样化满足您的多种科研及工业界需求。