
引言
细胞内钙离子(Ca2+)信号在生物学中普遍存在,是细胞信号传导的关键元素。现有的荧光传感器和报告基因虽然可以检测到Ca2+浓度升高的激活细胞,但这些方法需要通过植入物向深层组织传递光信号,无法在自由活动的动物中非侵入性地使用。8月5日Nature Methods的研究报道“Rapid, biochemical tagging of cellular activity history in vivo”,介绍了一种新型酶催化方法,通过在体内快速生化标记Ca2+浓度升高的细胞。该方法利用Ca2+激活的split-TurboID(CaST)酶,在外源生物素(biotin)分子的辅助下,在10分钟内标记激活的细胞。酶促信号随着Ca2+浓度和生物素标记时间的增加而增强,表明CaST可以作为总Ca2+活动的时间门控整合器。此外,与需要数小时才能产生信号的转录报告基因不同,CaST的读出可以在活动标记后立即进行。细胞内离子浓度的动态变化使细胞能够响应和适应其局部环境,最终有助于机体的正常生理功能。例如,神经元作为大脑的基本功能单元,可以被各种外部刺激或药理化合物激活,导致细胞内Ca2+浓度的快速波动。因此,通过细胞内Ca2+水平的变化可以直接衡量复杂神经网络的活动。遗传编码的Ca2+指示剂已经极大地改变了我们在清醒和活动的动物中记录神经活动的能力。然而,荧光传感器的一个主要限制是其读出信号是瞬时的,并且通常需要侵入性的方法才能获得深层脑结构的光学信号。这使得将给定神经元的活动历史与其众多其他细胞特性(例如精确的空间定位、RNA表达或蛋白质表达)相结合变得具有挑战性。为克服这一问题,先前的研究设计了正交转录报告基因(如FLARE、FLiCRE、Cal-Light)或荧光蛋白(如CaMPARI)以稳定标记在高细胞内Ca2+水平下激活的细胞。然而,这些方法都依赖光敏蛋白质,需要蓝光或紫外光来限制细胞活动标记的时间窗口。这一要求限制了其在深层脑区或无法植入光纤的体区的可扩展性。另一个稳定标记的方法包括基于即刻早期基因(IEG)的转录报告基因(如TRAP2和tetTag),这些方法利用药物注射而非光照来控制活动标记窗口。然而,虽然IEG活动已被证明与多种细胞类型的神经活动相关,但它远不如Ca2+作为通用的读出信号。此外,IEG表达的缓慢起效限制了在特定时间窗口内立即标记和识别激活的神经元的能力。在该研究中,研究人员设计了一种依赖于Ca2+的酶,通过将外源生物素分子连接到激活的细胞上,来报告活细胞内Ca2+水平的升高。重新设计并重新利用了一种近距离标记酶split-TurboID,以在活细胞内通过外源生物素分子标记蛋白质来报告细胞内Ca2+水平的升高。这种方法在不需要光照的情况下,能够在几分钟内标记细胞,为神经活动记录提供了一种快速、非侵入性的新策略。 细胞内钙离子(Ca2+)作为一种重要的信号分子,几乎参与了所有的细胞信号传导过程。在神经元中,Ca2+浓度的变化与神经活动密切相关,是研究神经网络活动的重要指标。目前,利用荧光传感器和报告基因可以检测Ca2+浓度升高的激活细胞,但这些方法往往需要侵入性操作,例如植入物来向深层组织传递光信号,这使得在自由活动的动物中进行非侵入性检测变得困难。为了克服这些限制,研究人员设计了一种基于酶催化的生化标记技术,能够快速标记Ca2+浓度升高的细胞。这项技术被称为Ca2+激活的split-TurboID(CaST),通过外源生物素(biotin)分子的辅助,在10分钟内完成标记。这种方法不仅快速,而且能够在不使用光照的情况下实现细胞标记,从而大大提高了其在深层脑区和其他体内组织中的应用潜力。研究团队首先设计了一种依赖Ca2+的酶,这种酶能够在Ca2+浓度升高时重组并激活,从而标记目标细胞。具体来说,CaST由两部分组成:一部分是与Ca2+结合的钙调蛋白(calmodulin,CaM),另一部分是合成肽M13。这两部分分别连接到split-TurboID的两个不活跃片段上(sTb(N)和sTb(C))。当细胞内Ca2+浓度升高时,CaM部分会被招募到M13,从而使split-TurboID重新组装并激活。在外源生物素存在的情况下,重组后的split-TurboID会标记自身及周围的蛋白质。研究人员在HEK293T细胞中表达了不同版本的CaST工具,通过生物素和Ca2+处理细胞,并用Alexa Fluor 647(SA-647)结合的链霉亲和素(streptavidin)染色来检测生物素标记的蛋白质。结果显示,在外源生物素存在下,CaST能够在Ca2+浓度升高时有效地标记目标蛋白质。为了验证CaST的有效性,研究团队进行了多种实验。他们将CaST的两个片段分别连接到不同的蛋白质上,并通过不同的组合方式表达在HEK293T细胞中。通过生物素和Ca2+的共同处理,研究人员发现其中一种组合(膜结合的CD4-sTb(C)-M13-GFP与胞质中的CaM-V5-sTb(N))表现出最高的信号背景比(signal-to-background ratio, SBR)。他们进一步优化了转染比例,发现5:2的转染比例(CD4-sTb(C)-M13-GFP(N))能够获得最佳的标记效果。通过荧光显微镜和western blot,研究人员验证了CaST在不同Ca2+浓度和刺激时间下的标记效果。结果显示,CaST的标记信号随着Ca2+浓度的增加和刺激时间的延长而增强,表明其具有良好的时间和浓度依赖性。具体实验中,研究人员在HEK293T细胞中表达CaST,并通过生物素和Ca2+共同处理细胞。通过荧光显微镜观察到,在生物素和Ca2+共同存在时,细胞内的生物素标记信号显著增强,而在仅有生物素或Ca2+单独存在时,标记信号较弱或不存在。
细胞内钙离子(Ca2+)作为一种重要的信号分子,几乎参与了所有的细胞信号传导过程。在神经元中,Ca2+浓度的变化与神经活动密切相关,是研究神经网络活动的重要指标。目前,利用荧光传感器和报告基因可以检测Ca2+浓度升高的激活细胞,但这些方法往往需要侵入性操作,例如植入物来向深层组织传递光信号,这使得在自由活动的动物中进行非侵入性检测变得困难。为了克服这些限制,研究人员设计了一种基于酶催化的生化标记技术,能够快速标记Ca2+浓度升高的细胞。这项技术被称为Ca2+激活的split-TurboID(CaST),通过外源生物素(biotin)分子的辅助,在10分钟内完成标记。这种方法不仅快速,而且能够在不使用光照的情况下实现细胞标记,从而大大提高了其在深层脑区和其他体内组织中的应用潜力。研究团队首先设计了一种依赖Ca2+的酶,这种酶能够在Ca2+浓度升高时重组并激活,从而标记目标细胞。具体来说,CaST由两部分组成:一部分是与Ca2+结合的钙调蛋白(calmodulin,CaM),另一部分是合成肽M13。这两部分分别连接到split-TurboID的两个不活跃片段上(sTb(N)和sTb(C))。当细胞内Ca2+浓度升高时,CaM部分会被招募到M13,从而使split-TurboID重新组装并激活。在外源生物素存在的情况下,重组后的split-TurboID会标记自身及周围的蛋白质。研究人员在HEK293T细胞中表达了不同版本的CaST工具,通过生物素和Ca2+处理细胞,并用Alexa Fluor 647(SA-647)结合的链霉亲和素(streptavidin)染色来检测生物素标记的蛋白质。结果显示,在外源生物素存在下,CaST能够在Ca2+浓度升高时有效地标记目标蛋白质。为了验证CaST的有效性,研究团队进行了多种实验。他们将CaST的两个片段分别连接到不同的蛋白质上,并通过不同的组合方式表达在HEK293T细胞中。通过生物素和Ca2+的共同处理,研究人员发现其中一种组合(膜结合的CD4-sTb(C)-M13-GFP与胞质中的CaM-V5-sTb(N))表现出最高的信号背景比(signal-to-background ratio, SBR)。他们进一步优化了转染比例,发现5:2的转染比例(CD4-sTb(C)-M13-GFP(N))能够获得最佳的标记效果。通过荧光显微镜和western blot,研究人员验证了CaST在不同Ca2+浓度和刺激时间下的标记效果。结果显示,CaST的标记信号随着Ca2+浓度的增加和刺激时间的延长而增强,表明其具有良好的时间和浓度依赖性。具体实验中,研究人员在HEK293T细胞中表达CaST,并通过生物素和Ca2+共同处理细胞。通过荧光显微镜观察到,在生物素和Ca2+共同存在时,细胞内的生物素标记信号显著增强,而在仅有生物素或Ca2+单独存在时,标记信号较弱或不存在。
CaST的功能和有效性验证(Credit: Nature Methods)
蛋白质结构预测:使用AlphaFold2预测了CaST的两个半部分蛋白质结构。图示展示了两部分在单独状态下(预期无Ca2+存在时)和复合状态下(预期高Ca2+存在时)的结构。两部分蛋白质在Ca2+依赖下可逆地重新组装。预测的生物素结合位点以蓝色显示。CaST设计:CaST在HEK细胞中的表达设计示意图。包含sTb(C)-M13-GFP的部分通过CD4细胞膜蛋白的跨膜域锚定在膜上,而CaM-V5标签-sTb(N)部分则在胞质中表达。只有在细胞接受生物素处理并表现出升高的细胞内Ca2+时,CaST才会标记蛋白质。荧光图像:HEK细胞的共聚焦图像,这些细胞同时转染了CaST的两个部分,并在±Ca2+的条件下处理30分钟生物素。细胞被洗涤、固定,并用抗V5和SA-647染色。抗V5信号标记了CaM-sTb(N)部分,而GFP荧光显示了CD4-sTb(C)-M13部分。蛋白质的生物素化通过SA-647染色检测。Western blot分析:HEK细胞被转染CaST并在±50 µM生物素和±Ca2+(5 mM CaCl2和1 µM ionomycin)条件下处理30分钟。细胞随后用Dulbecco’s磷酸盐缓冲液(DPBS)洗涤,收集全细胞裂解液,并使用链霉亲和素-辣根过氧化物酶(SA-HRP)或抗V5/HRP进行Western blot分析。‘N’表示预期的CaM-V5-sTb(N)片段大小,而‘C’表示预期的CD4-sTb(C)-M13-GFP片段大小。生物素化蛋白质的定量:量化了Western blot实验中的生物素化蛋白质。两次独立的生物重复进行了量化,整个条带下方的75-kDa内源性生物素化条带被纳入量化(总原始强度像素值的总和)。为了测试CaST的稳定性,研究人员将HEK细胞处理30分钟的Ca2+后洗涤10分钟,再加入生物素进行30分钟的标记。结果显示,洗涤后的细胞没有出现显著的标记信号,表明CaST的重组和激活是可逆的。此外,通过增加Ca2+浓度进行滴定实验,结果显示CaST的标记信号与Ca2+浓度呈线性相关,进一步验证了其高灵敏度和特异性。研究表明,CaST能够在体外和体内高效地标记Ca2+浓度升高的细胞。在HEK细胞实验中,CaST在生物素和Ca2+共同存在时表现出显著的标记信号,而在仅有生物素或Ca2+单独存在时,标记信号较弱或不存在。这表明CaST能够作为一种Ca2+依赖的标记工具,有效区分不同条件下的细胞活动。在进一步的实验中,研究人员通过荧光显微镜和西方印迹法验证了CaST在不同Ca2+浓度和刺激时间下的标记效果。结果显示,CaST的标记信号随着Ca2+浓度的增加和刺激时间的延长而增强,表明其具有良好的时间和浓度依赖性。
CaST的性能(Credit: Nature Methods)
HEK细胞的荧光显微镜图像:图像展示了转染CaST的HEK细胞在50 µM生物素和±Ca2+(5 mM CaCl2和1 µM ionomycin)条件下处理30分钟的情况。顶部显示SA-647染色的生物素化蛋白质,底部显示CD4-sTb(C)-M13-GFP。单细胞分析:单细胞分析结果显示了不同GFP表达水平下细胞的SA-647标记与GFP荧光强度的散点图。结果表明,在加生物素和Ca2+条件下,SA-647染色显著增加,而仅有生物素时则没有显著增加。SA-647/GFP荧光比率的分布:小提琴图展示了不同处理条件下单细胞SA-647/GFP荧光比率的分布。加生物素和Ca2+的条件下,SA-647/GFP比率显著高于其他条件。CaST-IRES构建设计示意图:展示了双顺反子CaST-IRES构建的设计,用于在HEK细胞中同时表达CaST的两个部分。CaST-IRES的荧光图像:展示了转染CaST-IRES的HEK细胞在50 µM生物素和±Ca2+条件下处理30分钟的情况。与之前类似,顶部显示SA-647染色的生物素化蛋白质,底部显示CD4-sTb(C)-M13-GFP。单细胞分析(CaST-IRES):散点图显示了不同处理条件下,GFP阳性细胞的平均SA-647与平均GFP荧光强度的关系。结果表明,在加生物素和Ca2+条件下,SA-647染色显著增加,而仅有生物素时则没有显著增加。SA-647/GFP荧光比率的分布(CaST-IRES):小提琴图展示了不同处理条件下单细胞SA-647/GFP荧光比率的分布。加生物素和Ca2+的条件下,SA-647/GFP比率显著高于其他条件。CaST非IRES与IRES版本的比较:图表展示了CaST非IRES和IRES版本在不同条件下的SA-647/GFP荧光比率的分布。IRES版本的CaST在加生物素和Ca2+条件下的标记效果显著优于非IRES版本。ROC曲线分析:ROC曲线分析显示了CaST非IRES和IRES版本区分Ca2+处理和非处理细胞群体的能力。非IRES版本的AUC为0.87,而IRES版本的AUC为0.93,表明IRES版本在区分活化与未活化细胞方面具有更高的精确度。神经元实验研究人员将CaST应用于培养的神经元中,验证其在神经细胞中的有效性。他们使用腺相关病毒(AAV)在大鼠海马神经元中表达CaST,并通过钾离子(KCl)刺激神经元,观察Ca2+浓度变化和CaST标记情况。结果显示,CaST能够在KCl刺激后的10分钟内有效标记Ca2+浓度升高的神经元。此外,研究人员还利用CaST检测了不同药理学试剂对神经元Ca2+浓度的影响。例如,多巴胺(dopamine,DA)和2,5-二甲氧基-4-碘苯丙胺(DOI)对神经元Ca2+浓度的调节效果。结果表明,DOI能够显著提高神经元内Ca2+浓度并引起CaST标记,而DA则未能显著影响Ca2+浓度。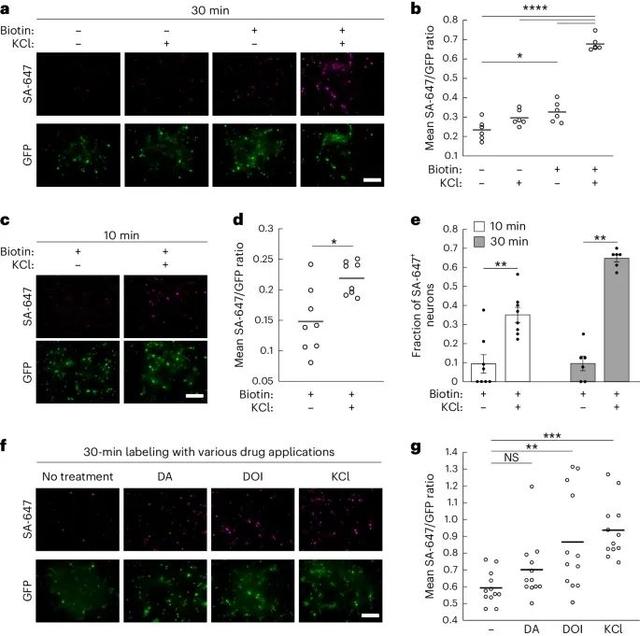
CaST在培养的神经元中的性能(Credit: Nature Methods)
神经元中CaST的表达和标记:a部分展示了培养的大鼠海马神经元中表达CaST的荧光显微镜图像。这些神经元被腺相关病毒(AAV)感染,表达CD4-sTb(C)-M13-GFP和CaM-sTb(N)两个部分,并在±生物素和±KCl条件下处理30分钟。图像显示了生物素化蛋白质的SA-647染色,GFP荧光标记了CD4-sTb(C)-M13。不同处理条件下的SA-647/GFP比率:b部分量化了图a中不同处理条件下的SA-647/GFP荧光比率。结果显示,+生物素 +KCl条件下的比率显著高于其他条件。10分钟KCl刺激后的CaST标记:c部分展示了神经元在10分钟±生物素和±KCl条件下处理后的荧光显微镜图像。结果显示,在生物素和KCl共同处理下,SA-647标记显著增强。10分钟标记的SA-647/GFP比率:d部分量化了图c中不同处理条件下的SA-647/GFP荧光比率。结果表明,在10分钟的KCl和生物素共同处理下,SA-647/GFP比率显著增加。GFP+神经元中的SA-647标记比例:e部分量化了10分钟和30分钟标记实验中,GFP+神经元中SA-647+细胞的比例。结果显示,在生物素和KCl共同处理下,10分钟标记的SA-647+细胞约占GFP+神经元的35%,而30分钟标记的则约占65%。而在仅有生物素处理下,SA-647+细胞比例较低(约10%)。不同药物处理后的CaST标记:f部分展示了大鼠海马神经元在50 µM生物素和10 µM DA、10 µM DOI或30 mM KCl条件下处理30分钟后的荧光显微镜图像。结果表明,DOI和KCl处理显著增加了SA-647标记,而DA处理未显著影响SA-647标记。不同药物处理条件下的SA-647/GFP比率:g部分量化了图f中不同药物处理条件下的SA-647/GFP荧光比率。结果显示,KCl和DOI处理显著增加了SA-647/GFP比率,而DA处理未显著影响该比率。动物实验研究人员进一步在小鼠模型中验证了CaST的应用。他们在小鼠前额叶皮层(prefrontal cortex,PFC)中表达CaST,并通过迷幻药物(如psilocybin)诱导神经元活动。通过测量小鼠的头部摆动反应(head-twitch response,HTR),研究人员发现,psilocybin能够显著增加PFC神经元的Ca2+浓度,并引起CaST标记。这一结果表明,CaST能够在自由活动的小鼠中,非侵入性地标记和检测神经活动。
CaST在小鼠体内非侵入性标记和检测psilocybin激活的神经元的能力(Credit: Nature Methods)
实验示意图:a部分展示了使用CaST标记psilocybin激活的神经元的实验流程。小鼠注射CaST病毒后,在自由活动状态下进行psilocybin处理,并通过生物素标记激活的神经元。随后进行SA-647染色和头部摆动反应(HTR)的测量。mPFC区域的SA-647和GFP荧光图像:b部分展示了前额叶皮层(mPFC)区域的荧光显微镜图像,对比了注射生物素+生理盐水和生物素+psilocybin的小鼠。结果显示,psilocybin处理的小鼠mPFC区域的SA-647标记显著增加。单个神经元的SA-647与GFP荧光强度:c部分量化了b部分中每个GFP+神经元的SA-647与GFP荧光强度。水平虚线表示生物素+生理盐水组中所有SA-647神经元的第90百分位阈值。FOV的SA-647/GFP比率:d部分量化了c部分中不同视野(FOV)的SA-647/GFP荧光比率。结果显示,psilocybin处理的小鼠比率显著高于生理盐水处理的小鼠。SA-647+神经元的比例:e部分展示了所有GFP+神经元中SA-647+神经元的比例。结果表明,psilocybin处理组中大约70%的GFP+神经元表现出强SA-647标记,而生理盐水处理组中这一比例较低。SA-647+神经元与HTR的相关性:f部分展示了SA-647+ mPFC神经元在HTR测量期间的细胞掩膜。具有相同数量HTR的视野来自相同的小鼠,但来自对侧半球的独立CaST注射。HTR数量与SA-647+神经元数量的关系:g部分量化了f部分数据中每平方毫米SA-647+神经元数量与HTR数量的关系。结果表明,SA-647+神经元数量与HTR数量呈正相关。HTR数量与SA-647/GFP比率的关系:h部分量化了f部分数据中所有神经元的平均SA-647/GFP比率与HTR数量的关系。结果显示,psilocybin处理组中具有HTR的小鼠的SA-647/GFP比率显著增加。与c-Fos的对比:i部分展示了psilocybin处理后mPFC区域的CaST GFP、SA-647和c-Fos染色图像。结果显示,psilocybin处理显著增加了SA-647标记,但对c-Fos标记影响较小。c-Fos+神经元数量:j部分量化了每平方毫米c-Fos+神经元数量。结果显示,psilocybin处理未显著增加mPFC区域的c-Fos标记。SA-647+神经元数量:k部分量化了每平方毫米SA-647+神经元数量。结果显示,psilocybin处理显著增加了mPFC区域的SA-647标记。SA-647+/GFP+神经元比例:l部分展示了每平方毫米FOV中SA-647+神经元占GFP+神经元的比例。结果表明,psilocybin处理显著增加了该比例。CaST技术的出现为细胞活动的非侵入性标记提供了一种新的工具。相比于传统的荧光传感器和转录报告基因,CaST具有标记速度快、非侵入性和高效的特点。这使得它在深层脑区和其他难以光学访问的体内组织中具有广泛的应用前景。未来,CaST有望被用于研究神经网络活动与行为之间的关系。例如,在研究迷幻药物对神经活动的影响时,CaST可以用来标记和分析药物作用下的神经元活动。此外,CaST还可以与其他空间分子成像技术结合,揭示特定时间窗内激活的神经元的基因表达和蛋白质分布情况,从而为神经科学研究提供更全面的视角。总之,CaST作为一种快速、非侵入性和高效的细胞活动标记工具,具有广阔的应用前景和重要的研究价值。通过进一步优化和扩展其应用范围,CaST有望在神经科学和其他生物医学领域产生深远的影响。参考文献
Zhang R, Anguiano M, Aarrestad IK, Lin S, Chandra J, Vadde SS, Olson DE, Kim CK. Rapid, biochemical tagging of cellular activity history in vivo. Nat Methods. 2024 Aug 5. doi: 10.1038/s41592-024-02375-7. Epub ahead of print. PMID: 39103446.https://www.nature.com/articles/s41592-024-02375-7责编|探索君
排版|探索君
转载请注明来源于【生物探索】
End