*仅供医学专业人士阅读参考
点击右上方“关注”,准时接收每日精彩内容推送。
牙周炎影响着全球50%以上的人口,并对生活质量产生重大影响,造成严重的牙槽骨缺损、牙齿脱落、咀嚼功能障碍和美观不佳。牙周炎患者牙槽骨的自然自我修复能力受到严重损害,这是由于促炎和抗炎巨噬细胞失衡以及细胞因子排泄过多,阻碍了细胞生物能和常驻干细胞的分化能力。在牙周炎的牙周韧带中,干细胞表现出严重的线粒体功能障碍,ATP生成减少。因此,能量代谢在干细胞分化和巨噬细胞极化中起着主导作用,而这两者对骨再生都至关重要。牙周炎常住细胞分化能力受损,免疫微环境紊乱,给骨再生带来巨大挑战。
来自上海交通大学的Xin Liu团队与来自中国科学院大学的王中林(四院院士)和李琳琳团队合作开发了一种压电水凝胶,通过生物能激活来挽救受损的成骨能力并重建再生免疫微环境。在局部机械应力作用下,压电水凝胶产生压电势,通过调节能量代谢和促进三磷酸腺苷(ATP)合成,启动炎性牙周韧带干细胞(PDLSCs)的成骨分化。此外,它还能通过将 M1 巨噬细胞转换为 M2 表型,重塑抗炎和促进再生的生态位。罗非鱼明胶和压电刺激的协同作用增强了大鼠牙周炎症缺陷的原位再生。这些发现为通过压电刺激调节能量代谢和免疫调节调理牙周炎和其他免疫相关骨缺损铺平了新的道路。相关工作以题为“Piezoelectric hydrogel for treatment of periodontitis through bioenergetic activation”的文章发表在2024年02月14日的国际顶级期刊《Bioactive Materials》。

本文亮点
• 开发出一种无线压电水凝胶,可在各种机械应力下有效产生电信号。
• 压电刺激可通过提高Δψm使受损的PDLSCs成骨分化。
• 压电水凝胶通过巨噬细胞的表型转换重建了抗炎和促进再生的生态位。
• 压电水凝胶使牙周炎症缺损的受损组织得以高质量再生。
1. 创新型研究内容
本研究团队受到电刺激可刺激线粒体产生 ATP 现象的启发,开发了一种无线压电刺激系统,以激活生物能,促进牙周炎中受伤组织的再生。为此,本研究构建了一种由压电四边形 BaTiO3 纳米粒子(t-BTO NPs)和罗非鱼明胶水凝胶制成的压电水凝胶。在机械激活条件下,触发的压电动势能改善炎性牙周韧带干细胞(PDLSCs)线粒体的生物能功能,并挽救其成骨分化。此外,压电刺激和罗非鱼明胶的内在抗炎活性共同作用,使巨噬细胞极性从促炎的 M1 表型转向抗炎的 M2 表型,从而促进成骨。因此,本研究成功地实现了大鼠牙周炎症性骨缺损的原位组织再生。
【压电水凝胶的合成与表征】
本研究将四方相压电 BaTiO3 NPs(t-BTO NPs)加入罗非鱼源甲基丙烯酰明胶(GelMA)中,制备了一种压电水凝胶。本研究团队之前的研究发现,罗非鱼来源的 GelMA 具有内在的抗炎活性,可以协同压电刺激的效果。本研究制作了非压电立方 BTO NPs(c-BTO NPs)作为假对照。在 t-BTO 的 X 射线衍射(XRD)图谱中,位于 2θ = 45°的两个分裂峰的出现表明其具有典型的包晶结构(图 1A),而 c-BTO NPs 则在相同位置显示出单一特征峰。从扫描电子显微镜(SEM)(图 1B,插图)、透射电子显微镜(TEM)图像(图 1C)和选区电子衍射(SAED,图 1D,插图)的结果来看,t-BTO NPs 的形态接近立方体,尺寸分布均匀,为 148.75 ± 4.2 nm,平面间距分别为 0.402 nm 和 0.398 nm,分别代表 BTO 的(001)平面和(100)平面。相比之下,c-BTO NPs 的形态相似,平均尺寸为 136.9 nm。能量色散 X 射线(EDX)图显示,Ba、Ti 和 O 元素分布均匀,原子比为 1:1:3(图 1E)。两种纳米粒子的 zeta 电位无明显差异。拉曼光谱中的 B1+E (307 cm-1)散射模式来自 [TiO6] 八面体的不对称振动(图 1F ),这也验证了非五对称结构和四方畸变。

图1 BTO NPs 的结构表征和压电特性
接下来,本研究使用 1H NMR确认 MA 已接枝到水凝胶中。SEM 和 EDX 图谱分析验证了 t-BTO NPs 成功加入到具有微米级多孔结构的 GelMA 水凝胶(GelMA + t-BTO 水凝胶)中(图 2A),但本研究的结果也显示 BTO NPs 在水凝胶中以团聚状态存在(图 2A),这表明在未来的工作中可能需要考虑 BTO NPs 在水凝胶中的均匀分布。GelMA + c-BTO 和 GelMA + t-BTO 水凝胶的抗压强度在 20-45 kPa 范围内,相应的弹性模量分别为 10.15 ± 3.41 KPa 和 14.85 ± 4.85 kPa(图 2B 和 C),这会促进干细胞的成骨分化过程。ICP-MS 数据进一步显示,在 PBS 中浸泡 7、14、28 和 56 天后,压电 GelMA + t-BTO 组提取物中的钡和钛含量显著增加,表明 t-BTO NPs 逐渐释放到局部微环境中,发挥各种生物功能。本研究通过检测组装好的压电发生器装置在各种力作用下的机械电响应,证实了压电水凝胶的压电性(图 2D)。图 2E 显示,在纯 GelMA 水凝胶的装置中没有检测到明显的电信号。对于 GelMA + t-BTO 水凝胶组装的发生器,在 200 kPa 的周期性恒定力作用下,开路电压(Voc)约为 52 mV,是 GelMA + c-BTO 水凝胶的 3.8 倍。此外,本研究还检测到 GelMA + t-BTO 水凝胶的发生器在 50-300 kPa 和 0.5-3.5 Hz 下的 Voc,这分别接近传递到牙周组织的应力和咀嚼运动的频率(图 2F 和 G)。如图 2G 所示,0.5 Hz 时的电输出为 32.7 mV,当频率达到 2.5 Hz 时增加到 113 mV。值得注意的是,当频率值超过 2.5 Hz 时,电压值保持不变,这是因为水凝胶发生了形变松弛。此外,当受到超声波刺激时,GelMA + t-BTO 水凝胶的装置会输出 40 mV 的电压,这表明基于 GelMA 的水凝胶具有很高的机电响应灵敏度(图 2H)。这些结果证实了 GelMA + t-BTO 水凝胶能在各种外力作用下有效地产生压电刺激电信号,鼓励我们将其用作无线纳米传感器,施加动态可调的压电刺激。

图2 压电水凝胶的压电特性表征
【无线压电刺激增强线粒体生物能,挽救受损的成骨过程】
本研究还评估了压电刺激能否挽救炎症性 PDLSCs 中受损的成骨能力。为了建立炎症模型,本研究用牙周病原体衍生的脂多糖(Pg-LPS)处理 PDLSCs,得到炎症性 PDLSCs,称为 L-PDLSCs。将 t-BTO NPs 培养后,对 L-PDLSCs 进行 US 照射以产生压电(图 3A)。初步确定了 US 的安全参数(0.6 W cm-2、1 MHz、60 s、50%占空比)和 t-BTO NPs 的剂量(50 μg mL-1),在此条件下,PDLSCs 表现出较高的存活率和增殖率。如图 3B 所示,经 t-BTO US+ 处理后,L-PDLSCs 中降低的细胞内 ATP 水平明显恢复到正常水平。相比之下,用 t-BTO 或 c-BTO US+ 处理的 L-PDLSCs 则没有观察到这种现象。此外,t-BTO US+处理也明显提高了 L-PDLSCs 的线粒体膜电位(Δψm)(图 3C 和 D)。
充足的能量供应是干细胞成骨分化的重要决定因素,这涉及胶原蛋白的生物合成以及骨基质蛋白和矿物质的沉积。本研究评估了压电刺激对 L-PDLSCs 成骨分化能力的影响,因为压电刺激能提高细胞 ATP 水平。实时定量聚合酶链反应(qRT-PCR)结果显示,经过 5 天的 t-BTO US+ 处理后,L-PDLSCs 的两个早期成骨标志物--碱性磷酸酶(ALP)和 Runt 相关转录因子 2(RunX2)的 mRNA 水平分别上调了 6 倍和 2 倍(图 3E 和 F)。相比之下,c-BTO US+和t-BTO US-处理均未对这些成骨分化相关基因产生任何影响。此外,在第 14 天,各组的 ALP 表达也反映了类似的变化趋势(图 3G、g)。此外,细胞外基质(ECM)矿化作为成骨分化的晚期标志物,在 t-BTO US+ 处理 21 天后也显著增强(图 3H,h)。这些结果表明,超声刺激下的 t-BTO NPs 可逆转 PDLSCs 的炎症状态,促进其成骨分化能力。

图3 压电刺激影响 L-PDLSCs 的 ATP 水平、线粒体膜电位 (Δψm)、成骨分化相关基因表达和矿化作用
【压电刺激介导的生物能激活和成骨分化机制】
为了研究生物能激活和促进成骨分化的潜在机制,本研究使用 RNA 测序(RNA-seq)技术检测了 L-PDLSCs 经 5 天 t-BTO US+ 刺激后的完整转录谱。热图(图 4A)和火山图(图 4B)显示,t-BTO US+ 组相对于 L-PDLSCs 组共有 1612 个差异表达基因(DEGs),其中 833 个 DEGs 上调。基因本体(GO)富集分析显示,前 20 个上调的生物过程集群包括参与有丝分裂的微管细胞骨架组织和微管细胞骨架组织(图 4D);前 20 个上调的生物过程集群包括参与有丝分裂的微管细胞骨架组织和微管细胞骨架组织(图 4E)。4D);细胞组分的前 20 个上调簇包括细胞骨架、微管细胞骨架、有丝分裂纺锤体和微管组织中心(图 4E);分子功能的前 20 个上调簇包括 ATPase 活性(耦合)、ATP 结合、ATP 依赖性微管运动活性、微管结合和微管运动活性(图 4F)。
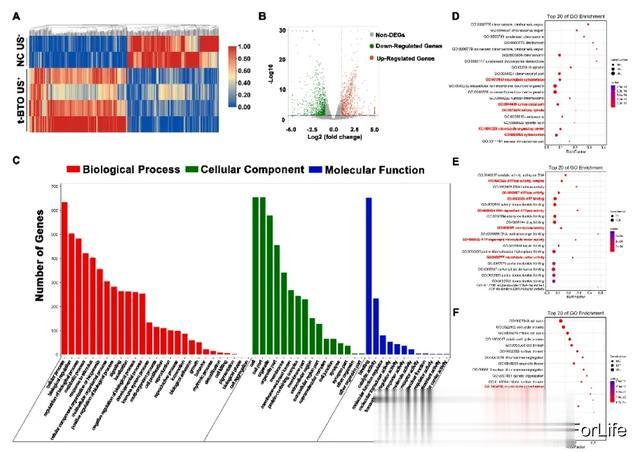
图4 压电刺激可增强L-PDLSCs基因图谱中的ATP酶活性和细胞骨架组织相关基因簇
作为一个由中间丝、微丝和微管组成的动态网络,细胞骨架参与了细胞迁移、粘附、有丝分裂和分化,其间肌球蛋白轻链(MLC)的磷酸化是一个关键的调节因子。MLC 的磷酸化还依赖于 Ca2+ 介导的肌球蛋白轻链激酶(MLCK)的活性,MLCK 激活肌球蛋白的 ATP 酶,并在 ATP 水解能的驱动下转移肌动蛋白丝,从而导致肌动蛋白丝的收缩和重组。因此,本研究假设充足的 ATP 供应和特定的细胞内 Ca2+ 活性可能是 PDLSCs 成骨分化过程中细胞骨架重组的先决条件。为了验证这一假设,本研究检测了磷酸化肌球蛋白轻链(p-MLC)。本研究采用 TEM 观察结合 ICP 分析来监测和测量 L-PDLSCs 对 t-BTO NPs 的摄取和内吞速率。结果表明,无论有无超声处理,c-BTO 和 t-BTO NPs 都定位于 L-PDLSCs 的细胞质中(图 5A)。值得注意的是,ICP结果显示,t-BTO NPs被L-PDLSC吞噬的比例从5.08%到10.97%不等,明显高于c-BTO组(0.84%-2.10%)(图S17)。免疫荧光染色结果(图5B-C)显示,t-BTO US+处理L-PDLSCs能显著上调p-MLC的表达,p-MLC纤维网络沿细胞长轴伸展并遍布胞质。相比之下,其他处理后 p-MLC 的表达没有明显变化,荧光主要分布在细胞周边。接着,本研究监测了压电刺激后细胞内 Ca2+ 浓度([Ca2+]i )的变化。如图 5D 所示,在 t-BTO US+ 组中,[Ca2+]i 持续升高并在 9 h 达到峰值,然后逐渐下降,但仍高于未处理的 L-PDLSCs。以前曾有报道称,造血干细胞在应激造血启动细胞分裂时,[Ca2+]i 会随着Δψm的升高而持续升高。研究还发现,[Ca2+]i 的增加能够恢复增殖潜能,并挽救年龄诱导的间充质干细胞功能丧失。

图5 压电刺激影响 L-PDLSCs 中 p-MLC 的表达和细胞间 Ca2+ 水平
【无线压电刺激重建再生免疫微环境】
除了成骨分化外,重建局部有利于再生的位置对牙周炎的骨再生也至关重要。本研究随后评估了压电刺激是否能诱导巨噬细胞 M2 极化以帮助再生(图 6A)。如图 6B 所示,LPS 处理会使原本球形的 RAW 264.7 细胞变得扁平,并带有许多延伸的伪足(称为 L-RAW 264.7 细胞),显示出 M1 巨噬细胞的典型形态特征。t-BTO US+处理使L-RAW 264.7细胞出现明显的伸长和F-肌动蛋白丝延伸(图6B和C)。更重要的是,t-BTO US+ 能显著上调作为 M2 巨噬细胞特异性生物标志物的精氨酸酶 1(Arg-1)的表达。它并没有明显影响作为 M1 巨噬细胞特异性生物标志物的诱导型一氧化氮合酶(iNOS)的表达(图 6D 和 E)。相比之下,假处理(t-BTO US-、c-BTO US-或 c-BTO US+)对它们的表达没有如此明显的影响,这证实了压电刺激对巨噬细胞 M2 极化的能力。本研究使用 RNA-seq 分析了经处理的 L-RAW 264.7 细胞的 DEGs。与 L-RAW 264.7 细胞相比,压电刺激后有 728 个 DEGs 下调,125 个 DEGs 上调。前 20 个富集的分子功能主要涉及跨膜通道集群,包括离子通道、离子门控通道、底物特异性通道、阳离子通道和电压门控离子通道(图 5H)。

图6 压电刺激调节巨噬细胞的 M2 极化
【压电水凝胶对牙周炎的活体调理】
有了压电刺激对体外成骨分化和巨噬细胞表型转换的积极影响,本研究紧接着探索了压电水凝胶在体内调理牙周炎的免疫调节和骨再生能力。本研究通过手术制备牙槽骨缺损并局部注射 Pg-LPS 建立了大鼠牙周炎骨缺损模型。成功建模的动物被随机分为四组:i) 空白对照组;ii) GelMA 水凝胶组;iii) GelMA + c-BTO 水凝胶组;iv) GelMA + t-BTO 水凝胶组(图 7A)。在牙周组织周围,压电水凝胶可在咀嚼等各种生理活动下产生压电刺激。显微 CT 成像结果显示,GelMA + t-BTO 调理后,矿化度提高,缺损面积缩小。经过 12 周的长期调理后,GelMA + t-BTO 组的初始缺损面积几乎完全恢复(图 7B)。相比之下,12 周后,在包括 GelMA 的其他两组(ii 组和 iii 组)中观察到了有限的骨组织再生和更多的牙根暴露,而在空白对照组中,由于骨组织在炎性微环境中的自我修复能力有限,牙根暴露情况恶化(图 7B)。通过对新骨量(BV)、骨量/总骨量(BV/TV)和骨矿物质密度(BMD)进行定量分析,进一步评估了骨再生情况(图 6C-E)。4 周后,GelMA + t-BTO 组(63.40 ± 5.58%)的 BV/TV 显著高于包括 GelMA 的其他两组(GelMA 组为 40.85 ± 10.27%,GelMA + c-BTO 组为 40.37 ± 13.07%)和空白对照组(44.15 ± 10.01%)。12 周时,与空白对照组相比,其他三个 GelMA 组的 BV/TV 均有所增加,其中 GelMA + t-BTO 组的骨体积分数最高(91.45 ± 5.68 %),增加了 223.8%。在 GelMA + t-BTO 组也观察到了令人兴奋的 BV 和 BMD 增加趋势。

图7 压电水凝胶促进牙周炎-牙周缺损的骨再生
本研究进一步关注了压电水凝胶是否能通过重新平衡巨噬细胞的 M1/M2 表型来创造一种局部促再生免疫微环境。调理 12 周后,通过免疫荧光染色分析牙周缺损处的 M1 巨噬细胞表型(以 iNOS 为标记)和 M2 巨噬细胞表型(以 CD206 为标记)。在空白对照组中,12 周时缺损区出现了更多的 M1 巨噬细胞。在三个 GelMA 水凝胶组,尤其是 GelMA + t-BTO 组,M1 巨噬细胞明显减少,而 M2 巨噬细胞增加(图 8A-C)。此外,采集大鼠唾液分析促炎细胞因子的水平,包括白细胞介素 1β (IL-1β)、白细胞介素 6(IL-6)和肿瘤坏死因子α(TNF-α)。正如预期的那样,在牙周缺损处局部注射 Pg-LPS 会诱发局部炎症微环境,产生高水平的 IL-1β、IL-6 和 TNF-α(图 8D)。处理后,三个 GelMA 水凝胶处理组中 IL-1β、IL-6 和 TNF-α 的浓度都有所下降,其中 GelMA + t-BTO 压电水凝胶的效果最明显(图 8D)。
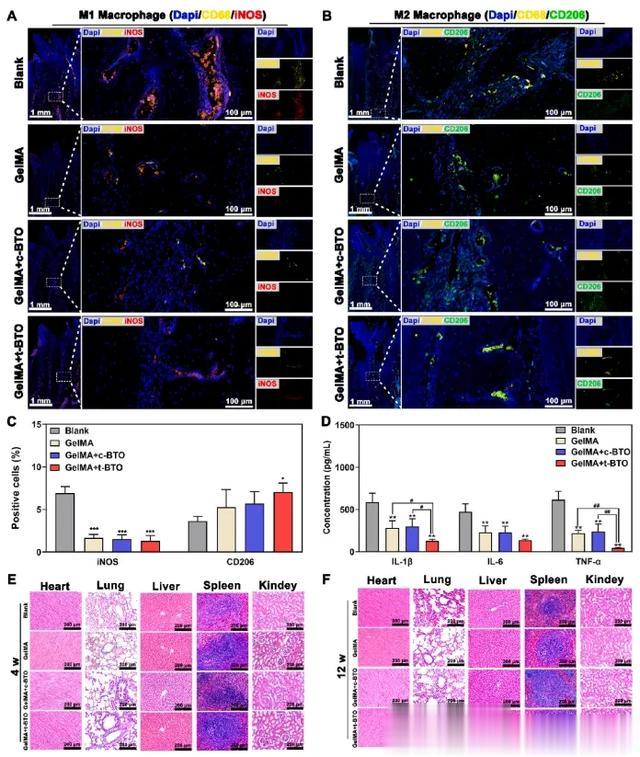
图8 压电水凝胶对牙周炎-牙周缺损无重大器官损伤,并通过调节 M1/M2 巨噬细胞减少炎症反应
2. 总结与展望
总之,本研究开发了一种生物相容性压电水凝胶,由罗非鱼衍生的 GelMA 水凝胶和 t-BTO NPs 制成,通过调节免疫调节和骨生成调理牙周炎。压电刺激通过升高Δψm启动炎性PDLSCs的ATP合成,驱动下游耗能事件,包括细胞骨架重组和成骨分化。此外,压电水凝胶还具有适当的免疫调节作用和优异的成骨能力。在大鼠牙周炎症性骨缺损中,在罗非鱼明胶和压电刺激的协同作用下,压电水凝胶可通过表型从 M1 巨噬细胞转换为 M2 巨噬细胞,形成抗炎和促进再生的生态位,挽救成骨过程,并显著促进原位骨再生。这些研究结果验证了压电刺激可实现能量代谢和免疫调节,从而挽救炎症微环境中受损的干细胞分化,促进骨再生。
了解更多
关注“EngineeringForLife”,了解更多前沿科研资讯~
