
引言
随着高通量分子测序和分析技术的不断进步,我们对大脑衰老过程中生理特征的理解正变得更加精确和深入。特别是针对阿尔茨海默病(AD)患者大脑不同区域进行的单细胞水平分析,已经为揭示AD的病理特征提供了更加明确的见解【1,2】。尽管近年来的研究为我们展现了AD中多种细胞状态的变化模式,但这些变化如何以及在何时对AD的发病和进展产生具体影响,仍需进一步研究。
虽然传统上使用大块组织进行大脑样本分析可以揭示AD的一些分子特征,但这种方法的缺点在于难以捕捉大脑复杂细胞组成及相关的分子变化。单细胞RNA测序(scRNA-seq)和单核RNA测序(snRNA-seq)技术能够识别和追踪大脑中的多种细胞类型,如神经元、胶质细胞、血管细胞等,研究发现这些细胞在AD发展中的基因表达模式出现显著变化【3】。此外,越来越多的证据表明,AD的病变不仅限于单一类型的细胞退行性病变,而是涉及多细胞群体的复杂网络。例如,胶质细胞(尤其是小胶质细胞)在AD发病中不仅参与免疫反应,还通过分泌细胞因子影响神经元的健康状态;血管细胞的功能障碍可能影响大脑的血脑屏障,从而导致毒性物质在脑组织中的积累,加剧了AD的病理进展【4】。
然而,尽管这些技术揭示了大量的细胞类型和功能变化,要真正理解这些细胞状态在AD发生中的作用,仍存在两个关键的挑战。首先,如何准确识别和区分AD相关的特异性细胞群体变化,尤其是与正常脑老化机制之间的界限尚不清晰,许多分子和细胞特征在正常老化和AD中都有重叠。其次,如何建立起一个系统的因果链,将无症状阶段的病理积累与认知功能下降,以及AD的临床表现联系起来,是亟待解决的另一大难题。
近日,哥伦比亚大学Philip L. De Jager实验室与耶路撒冷希伯来大学Naomi Habib等合作,在Nature上发表题为Cellular communities reveal trajectories of brain ageing and Alzheimer’s disease的文章,该研究通过snRNA-seq构建了老化前额叶皮层的细胞图谱,鉴定了与AD相关的特定胶质细胞和神经元亚群,发现两种不同的微胶质细胞亚群分别驱动了淀粉样蛋白和tau蛋白病变过程,以及一种星形胶质细胞亚群与认知衰退有关。此外,作者还通过模拟细胞环境的动态变化,识别出了两条大脑老化的轨迹,一条导致AD,一条导致其他类型的大脑老化。本研究为揭示AD的病理机制提供了新的见解。
 为了探究AD和其他类型大脑老化间的分子机制差异,研究者对脑组织背外侧前额叶皮层(DLPFC)进行前瞻性采样,样本涵盖了老年人中AD和脑老化的所有临床病理阶段。通过对437名参与者样本进行单核RNA测序,结合三个AD相关特征:新皮质中的Aβ负担、tau负担,以及认知衰退率,作者鉴定到了多种细胞类型及其亚群,构建了一个全面的老化DLPFC细胞图谱。通过因果中介分析和结构方程模型(SEM)识别与阿尔茨海默病(AD)进程相关的关键细胞亚群,作者发现Mic.12细胞亚群与Aβ积累的上游过程相关,且与年龄相关的微胶质细胞功能障碍有关。Mic.13细胞亚群位于Aβ下游,主要通过tau依赖机制影响认知衰退,并与遗传风险因子APOE ε4相关。Ast.10细胞亚群则位于tau和认知衰退之间,既影响tau病理又通过其他机制促进认知衰退。Oli.7细胞亚群与Ast.10细胞亚群密切相关,进一步推动了AD的进展。通过这些细胞亚群的组合,作者构建了AD的完整级联模型,揭示了潜在的因果路径。进一步研究发现,Mic.12和Mic.13这两种微胶质细胞亚群在阿尔茨海默病(AD)中扮演不同角色。两者都表达AD易感基因(如APOE),但Mic.12与Aβ积累相关,而Mic.13则与tau聚集和认知衰退相关。Mic.12和Mic.13在细胞形态和功能上也有所不同,Mic.13表现为激活的微胶质细胞,与tau负担存在强相关。通过将每位受试者视为在细胞变化轨迹上的一个时间点,作者重建了衰老过程中细胞变化的轨迹(BEYOND框架),并利用BEYOND框架探究了老年人脑细胞环境的异质性(图1)。利用BEYOND框架构建细胞环境的高维空间后,作者识别出两种主要的衰老变化轨迹:一种与AD进程相关,称为 “prAD”,表现为皮层Aβ和tau负担的持续增加以及认知衰退的加速;另一种为“替代性脑老化(ABA)”,表现为Aβ水平稳定、低tau负担和较慢的认知衰退速度。
为了探究AD和其他类型大脑老化间的分子机制差异,研究者对脑组织背外侧前额叶皮层(DLPFC)进行前瞻性采样,样本涵盖了老年人中AD和脑老化的所有临床病理阶段。通过对437名参与者样本进行单核RNA测序,结合三个AD相关特征:新皮质中的Aβ负担、tau负担,以及认知衰退率,作者鉴定到了多种细胞类型及其亚群,构建了一个全面的老化DLPFC细胞图谱。通过因果中介分析和结构方程模型(SEM)识别与阿尔茨海默病(AD)进程相关的关键细胞亚群,作者发现Mic.12细胞亚群与Aβ积累的上游过程相关,且与年龄相关的微胶质细胞功能障碍有关。Mic.13细胞亚群位于Aβ下游,主要通过tau依赖机制影响认知衰退,并与遗传风险因子APOE ε4相关。Ast.10细胞亚群则位于tau和认知衰退之间,既影响tau病理又通过其他机制促进认知衰退。Oli.7细胞亚群与Ast.10细胞亚群密切相关,进一步推动了AD的进展。通过这些细胞亚群的组合,作者构建了AD的完整级联模型,揭示了潜在的因果路径。进一步研究发现,Mic.12和Mic.13这两种微胶质细胞亚群在阿尔茨海默病(AD)中扮演不同角色。两者都表达AD易感基因(如APOE),但Mic.12与Aβ积累相关,而Mic.13则与tau聚集和认知衰退相关。Mic.12和Mic.13在细胞形态和功能上也有所不同,Mic.13表现为激活的微胶质细胞,与tau负担存在强相关。通过将每位受试者视为在细胞变化轨迹上的一个时间点,作者重建了衰老过程中细胞变化的轨迹(BEYOND框架),并利用BEYOND框架探究了老年人脑细胞环境的异质性(图1)。利用BEYOND框架构建细胞环境的高维空间后,作者识别出两种主要的衰老变化轨迹:一种与AD进程相关,称为 “prAD”,表现为皮层Aβ和tau负担的持续增加以及认知衰退的加速;另一种为“替代性脑老化(ABA)”,表现为Aβ水平稳定、低tau负担和较慢的认知衰退速度。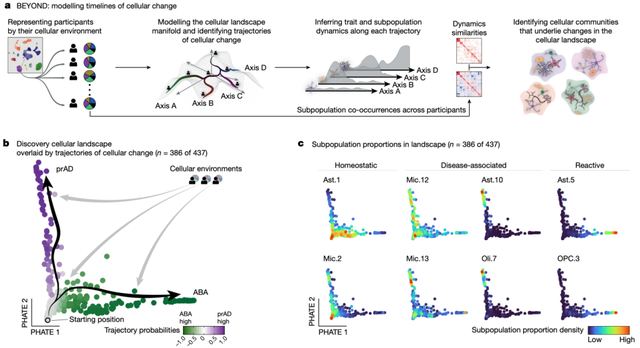
图1 BEYOND模拟细胞动态发展的两条轨迹AD和ABA(Credit: Nature)
此外,prAD轨迹中的细胞群体(如Mic.12、Mic.13、Ast.10)在AD相关的Aβ和tau负担增加时上升,而ABA轨迹中的细胞群体(如C1、C1.1)则下降。通过空间转录组数据验证,这些轨迹在不同的脑区域表现出不同的细胞群体分布。可见,老年大脑中存在着两种主要细胞级联模式,分别与AD进展和替代性脑老化相关。综上所述,本研究通过单核RNA测序,构建了一个老化前额叶皮层的细胞图谱,揭示了阿尔茨海默病(AD)相关的特定胶质细胞和神经元亚群。因果模型发现两种不同的与脂质相关的微胶质细胞亚群分别参与了淀粉样蛋白和tau蛋白的病变过程,以及一种星形胶质细胞亚群与认知衰退有关。此外,作者还模拟出了两条不同的大脑老化轨迹,一条导致AD,另一条则通向其他类型的大脑老化。本研究为解析AD的发生和进展机制提供了新视角,并有助于开发针对不同细胞群体的个性化治疗策略。参考文献
1. Mathys, Hansruedi, et al. Single-cell multiregion dissection of Alzheimer’s disease. Nature (2024): 1-11.2. Mostafavi, S. et al. A molecular network of the aging human brain provides insights into the pathology and cognitive decline of Alzheimer’s disease.Nat. Neurosci. 21, 811–819 (2018).3. Yang, A. C. et al. A human brain vascular atlas reveals diverse mediators of Alzheimer’s risk.Nature603, 885–892 (2022).4. Cain, Anael, et al. Multicellular communities are perturbed in the aging human brain and Alzheimer’s disease. Nature neuroscience 26.7 (2023): 1267-1280.https://doi.org/10.1038/s41586-024-07871-6责编|探索君
排版|探索君
文章来源|“BioArt”
End