
引言
外周T细胞淋巴瘤(Peripheral T Cell Lymphoma, PTCL)是一种罕见且高度侵袭性的血液恶性肿瘤,患者面临着极高的复发率和有限的治疗选择。尽管传统化疗和靶向治疗在部分患者中取得了短暂的缓解,但大多数患者在短时间内面临疾病复发的风险,亟需新的治疗策略。11月11日 Nature Medicine的报道“TRBC1-CAR T cell therapy in peripheral T cell lymphoma: a phase 1/2 trial”,TRBC1-CAR T细胞疗法为PTCL患者带来了新的希望,这种基于患者个体化T细胞重编程的疗法,利用T细胞受体β链恒定区(TRBC)特异性表达实现精准攻击恶性T细胞,并避免对正常免疫功能的过度抑制。

外周T细胞淋巴瘤(Peripheral T Cell Lymphoma, PTCL)是一种高度侵袭性的非霍奇金淋巴瘤(Non-Hodgkin Lymphoma, NHL),约占所有NHL的10-15%,同时约占所有血液系统恶性肿瘤的3%。PTCL的标准治疗方法通常包括CHOP化疗方案(环磷酰胺、阿霉素、长春新碱和泼尼松),并在某些病例中加用乙托泊苷(Etoposide),对于CD30阳性的间变性大细胞淋巴瘤(Anaplastic Large Cell Lymphoma, ALCL),则采用Brentuximab Vedotin等药物。
尽管这些治疗方法在部分患者中取得了短暂的疗效,但对于多数PTCL患者而言,复发及难治性(Relapsed/Refractory, r/r)仍是普遍存在的问题。数据显示,复发/难治性PTCL患者的中位无进展生存期(Progression-Free Survival, PFS)和总体生存期(Overall Survival, OS)均低于6个月。相较于B细胞淋巴瘤的治疗进展,PTCL因缺乏特异性靶抗原来区分恶性T细胞与正常T细胞,面临巨大的治疗挑战,使得针对性的免疫治疗策略在PTCL中的应用受到严重限制。
B细胞淋巴瘤的成功靶向治疗得益于B细胞抗原CD19的存在,这使得CAR T细胞疗法在复发性或难治性B细胞恶性肿瘤中取得了显著疗效。然而,直接靶向T细胞抗原可能会导致对正常T细胞的严重破坏,造成深度的免疫功能缺陷,这在PTCL的治疗中是不被接受的。
为了克服这一困境,研究者提出了一种基于T细胞受体β链恒定区(T Cell Receptor Beta-Chain Constant Region, TRBC)特异性表达的靶向策略。T细胞受体β链恒定区由两个基因编码:TRBC1和TRBC2。在正常T细胞中,TRBC1和TRBC2的比例约为2:3,而在恶性T细胞中,通常只表达其中一个基因。因此,通过选择性靶向TRBC1或TRBC2,可以实现对恶性T细胞的精准攻击,同时保留正常的T细胞,从而减少免疫抑制风险。
此外,TRBC1和TRBC2的特异性表达使得TRBC1成为一个理想的靶点。相比于B细胞淋巴瘤靶向CD19的成功案例,TRBC1靶向策略为CAR T疗法在T细胞淋巴瘤中的应用提供了新思路。由于在恶性克隆中,只有一种TRBC恒定区被表达,靶向TRBC1或TRBC2可以实现对恶性细胞的选择性清除,避免了对正常T细胞的全面攻击,降低了免疫系统崩溃的风险。这种特异性设计为免疫治疗的精准化提供了理论和实践上的双重保障。
研究设计:AUTO4 CAR T细胞LibraT1研究是一项I/II期、多中心临床试验,旨在评估TRBC1特异性CAR T细胞(AUTO4)在TRBC1阳性复发/难治性PTCL患者中的安全性和耐受性。所有患者在接受AUTO4治疗前均须进行TRBC1筛查,以确定其适合性。
AUTO4是一种基于TRBC1的CAR T细胞疗法,利用患者自身的T细胞进行提取,并通过基因转导使其表达特异性的CAR。CAR由Jovi-1抗体的单链可变片段(Single-Chain Variable Fragment, scFv)构建,Jovi-1对TRBC1具有高度选择性,进一步融合了CD8α茎和41BB-CD3ζ共刺激结构域和信号转导域,以增强细胞杀伤效果和持久性。
AUTO4的制备过程涉及多个复杂的步骤。首先,从患者血液中分离出T细胞,这些T细胞经过基因转导后表达特定的CAR结构域。随后,经过扩增和纯化处理后,将这些CAR T细胞再次输注回患者体内。在这一过程中,Jovi-1抗体的作用至关重要,因为它能够高度选择性地识别TRBC1,确保CAR T细胞只对TRBC1阳性的恶性T细胞产生杀伤作用,而不影响正常的TRBC2阳性T细胞。
该研究中的患者接受了氟达拉滨和环磷酰胺的预处理,以确保淋巴细胞耗竭,这一步骤对于提高CAR T细胞的扩展和持久性至关重要。这种预处理可以减少体内竞争性免疫细胞的数量,从而为CAR T细胞提供更有利的扩展环境。此外,AUTO4的结构设计中融合了41BB共刺激结构域,这一结构域可以显著增强CAR T细胞的持久性,延长其在体内的存活时间并增强其抗肿瘤活性。
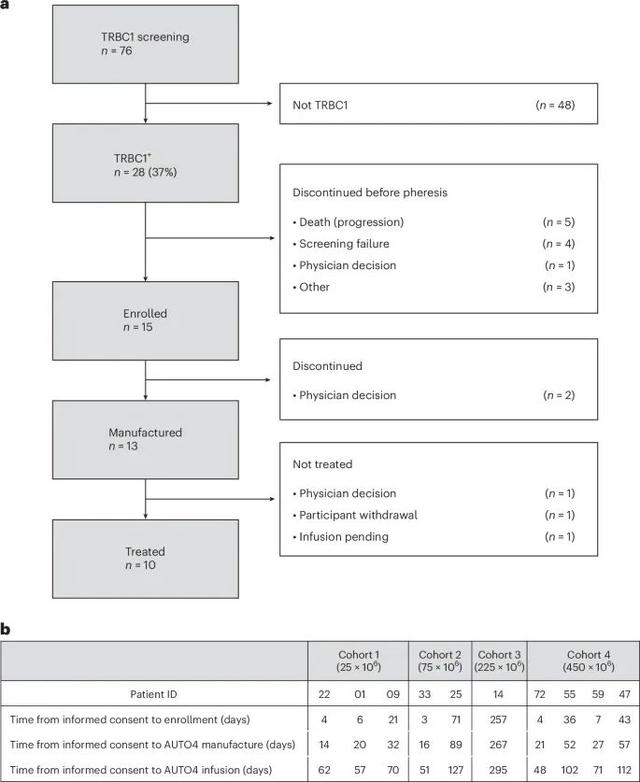
AUTO4/LibraT1研究的患者筛选和治疗流程(Credit: Nature Medicine)
首先对76名复发/难治性PTCL患者进行了TRBC1筛查,其中28名(37%)为TRBC1阳性,并最终纳入了15名患者进行试验。在筛查过程中,部分患者因疾病进展或筛查失败等原因未能继续。在治疗过程中,共有13名患者成功制备了AUTO4 CAR T细胞,并有10名患者最终接受了AUTO4输注治疗。
患者筛选与治疗过程截至2023年4月,共有76名复发/难治性PTCL患者进行了TRBC1筛查,其中28名患者(37%)被确定为TRBC1阳性。这些患者中,有13名成功制备了AUTO4,最终10名患者接受了AUTO4的输注治疗。
LibraT1研究将患者随机分配至四个不同的剂量组:25 × 10^6、75 × 10^6、225 × 10^6、450 × 10^6 CAR T细胞。患者在接受AUTO4前需进行氟达拉滨(Fludarabine, Flu)和环磷酰胺(Cyclophosphamide, Cy)的淋巴细胞耗竭预处理,以增强CAR T细胞的扩展和效果。
患者从知情同意到AUTO4制备和输注的时间各有差异。例如,Cohort 1中患者22从知情同意到入组仅用了4天,而Cohort 3中患者25则用了71天。AUTO4的制备时间也有显著差异,Cohort 2中患者33花费了16天,而Cohort 3中患者25花费了89天。整个输注过程从知情同意到AUTO4最终输注的时间跨度从48天到295天不等。
这些数据表明,AUTO4的制备和输注过程存在一定的挑战,需要综合考虑患者的个体差异和制备过程的复杂性。尽管制备周期存在较大差异,但研究显示,AUTO4在不同患者中均表现出了良好的安全性和耐受性,未发生明显的制备失败或不可控制的延迟。
安全性与副作用AUTO4的安全性是LibraT1研究的核心考察对象。数据显示,在接受最高剂量(450 × 10^6)的四名患者中,有三名出现了1-2级的细胞因子释放综合征(Cytokine Release Syndrome, CRS),而仅有一名患者出现了3级CRS,且在治疗后迅速得到缓解。研究中未观察到任何级别的免疫细胞相关神经毒性综合征(ICANS)或剂量限制性毒性(Dose-Limiting Toxicity, DLT)。
具体不良事件方面,40%的患者经历了3级中性粒细胞减少,20%的患者出现了≥3级的血小板减少,40%的患者出现了≥3级的贫血。所有患者在接受氟达拉滨和环磷酰胺预处理后均出现了淋巴细胞减少,但在AUTO4输注后约三周内恢复至基线水平。
此外,有两名患者在治疗期间经历了EB病毒(Epstein–Barr Virus, EBV)的再激活。其中一名患者在第27天出现了2级EBV再激活,另一名患者在第29天出现了1级感染。第一名患者接受了利妥昔单抗(Rituximab)治疗,事件在第93天得到解决,而第二名患者未接受任何治疗。
CRS是CAR T细胞治疗中的常见不良事件,其严重程度与CAR T细胞的扩展和活性密切相关。在LibraT1研究中,尽管部分患者经历了CRS,但通过及时的干预,包括使用托珠单抗(Tocilizumab)和皮质类固醇,这些症状均得到了有效控制。相较于其他类型的CAR T细胞治疗,AUTO4在高剂量下的CRS发生率和严重程度相对可控,进一步证明了其在安全性方面的优势。
疗效评估在10名接受AUTO4治疗的患者中,有6名患者在PET-CT评估中达到了部分缓解或完全缓解,其中4名患者达到了完全代谢缓解(Complete Metabolic Response, CMR)。在最高剂量组中,所有四名患者均达到了客观缓解(Objective Response, OR),三名为完全缓解,一名为部分缓解。值得注意的是,在这些达到完全缓解的患者中,有两名患者的缓解持续时间超过了18个月,且未接受其他抗淋巴瘤治疗,显示出AUTO4在部分患者中具有持久疗效的潜力。
尽管在外周血中未能检测到显著的AUTO4扩展,研究者在患者的病灶淋巴结活检中检测到了AUTO4的存在,表明这些CAR T细胞能够定向迁移至肿瘤部位并在肿瘤微环境中发挥作用。在对五名患者的后续淋巴结活检中,所有患者的淋巴结中均检测到AUTO4的渗透,且其拷贝数从111到171,700不等,表明CAR T细胞在肿瘤部位的浸润和活跃。
这一发现具有重要意义,表明AUTO4能够在肿瘤微环境中保持活性,并发挥持续的抗肿瘤效应。CAR T细胞的扩展性和持久性一直是衡量其疗效的重要指标,尽管AUTO4在外周血中的扩展不显著,但其在肿瘤局部的浸润能力和有效性证明了其设计的合理性。未来的研究可能需要进一步优化CAR T细胞的制备过程,增强其在体内的扩展性,从而提高整体疗效。
AUTO4 CAR T细胞的优势与挑战TRBC1靶向策略的优势AUTO4的核心优势在于其选择性靶向TRBC1阳性T细胞的能力,从而尽可能减少对正常T细胞的影响。这一特异性靶向策略通过利用TCR基因重排的克隆特征实现,使得在不显著抑制正常T细胞的情况下有效杀伤恶性T细胞。相较于靶向CD5或CD7等T细胞抗原的CAR T细胞疗法,AUTO4有效避免了CAR T细胞的自杀性攻击(Fratricide)和严重免疫抑制。
此外,TRBC1靶向策略的另一个优势在于其潜在的可扩展性。由于TRBC1和TRBC2在正常T细胞中的比例较为恒定,针对TRBC1的治疗可以在保留相当一部分正常T细胞功能的前提下实现对肿瘤的特异性攻击。这种靶向策略不仅降低了治疗的免疫相关副作用,还为CAR T疗法在更广泛的T细胞恶性肿瘤中的应用提供了可能性。
持久性与扩展性的挑战尽管AUTO4在肿瘤病灶的淋巴结中表现出良好的浸润,但在外周血中的扩展效果并不显著,提示其体内扩展性可能受限。这种现象可能与CAR T细胞的制备过程、分化状态、预处理强度以及正常TRBC1+ T细胞对AUTO4的反向攻击等多种因素有关。
为了应对这一挑战,未来的研究建议可能需要提高淋巴细胞耗竭的强度,或优化CAR T细胞的制备流程,例如缩短扩增周期,或在扩增过程中加入达沙替尼(Dasatinib)等药物,以增强CAR T细胞的持久性和扩展能力。此外,研究者还可以考虑采用更先进的基因编辑技术,如CRISPR,以进一步增强CAR T细胞的抗肿瘤活性和体内持久性。
另外,T细胞的分化状态在CAR T细胞的持久性和扩展性中起着重要作用。未来的优化策略可能包括在制备过程中对T细胞进行更精确的分化控制,以获得具有较强扩展能力和抗疲劳性的CAR T细胞群体。这些改进有望进一步提高AUTO4在体内的扩展性,从而增强其整体疗效。
AUTO4作为一种新型TRBC1靶向CAR T细胞疗法,在LibraT1研究中展示出了一定的安全性与疗效,尤其是在高剂量组中,部分患者获得了持久的完全缓解。尽管目前研究规模有限,且存在一些需进一步解决的技术瓶颈,如CAR T细胞的持久性和体内扩展性,但AUTO4的前景依然令人振奋。
随着未来更多患者的纳入及CAR T制备工艺的改进,AUTO4有望进一步展示其在PTCL治疗中的潜力,并可能成为这一领域的重要治疗选择。未来的研究可以探讨联合治疗策略,例如将AUTO4与免疫检查点抑制剂或其他靶向治疗联合使用,以进一步提高疗效。此外,AUTO4在不同类型T细胞恶性肿瘤中的潜力也值得进一步研究,以期将这种特异性靶向策略扩展到更多患者群体中。
参考文献
Cwynarski, K., Iacoboni, G., Tholouli, E. et al. TRBC1-CAR T cell therapy in peripheral T cell lymphoma: a phase 1/2 trial. Nat Med (2024). https://doi.org/10.1038/s41591-024-03326-7责编|探索君
排版|探索君
转载请注明来源于【生物探索】
声明:本文仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!
End