
引言
线粒体作为细胞内的能量代谢细胞器,其功能障碍与一系列肝脏病变相关。在脂肪肝,肝硬化和肝衰竭等疾病中,均发现线粒体电子传递链 (ETC) 复合物的活性被抑制,线粒体膜电位下降等问题【1-4】。肝脏作为再生能力极强的器官,但是其再生过程中,线粒体的功能尚不明确。
2024年6月14日,德克萨斯大学西南医学中心Prashant Mishra实验室的博士后王逊等在Science杂志发表了题为Metabolic inflexibility promotes mitochondrial health during liver regeneration的研究论文,发现肝脏再生过程中,线粒体通过其代谢的不灵活性,保护再生肝脏健康。

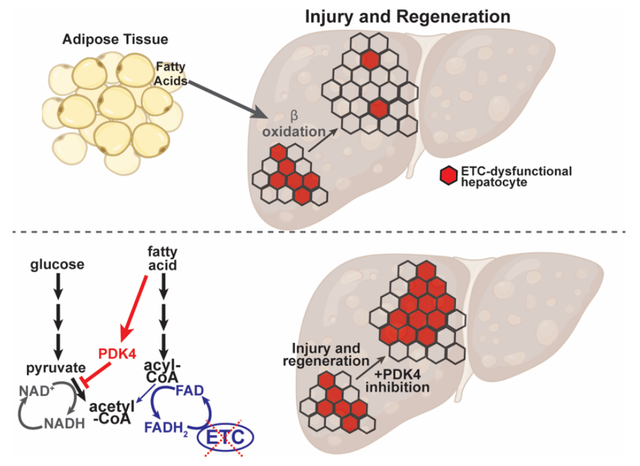 外周脂肪组织分解,产生的脂肪酸通过β-氧化,支持正常肝细胞增殖。线粒体ETC缺失的肝细胞,无法利用脂肪酸,使其堆积,进而抑制丙酮酸到乙酰辅酶A的转化,使其无法增殖。当PDK4被抑制时,线粒体ETC缺失的肝细胞,通过利用丙酮酸来源的乙酰辅酶A进行增殖。(Credit: Science)综上所述,本研究发现肝脏再生过程中,肝脏利用其代谢的不灵活性,通过脂质积累,抑制线粒体ETC功能障碍的肝细胞的增殖,以保护肝脏健康。参考文献1. C. Koliaki et al., Adaptation of hepatic mitochondrial function in humans with non-alcoholic fatty liver is lost in steatohepatitis. Cell Metab 21, 739-746 (2015).2. M. Perez-Carreras et al., Defective hepatic mitochondrial respiratory chain in patients with nonalcoholic steatohepatitis. Hepatology 38, 999-1007 (2003).3. H. Cortez-Pinto et al., Alterations in liver ATP homeostasis in human nonalcoholic steatohepatitis: a pilot study. JAMA 282, 1659-1664 (1999).4. B. Fromenty, M. Roden, Mitochondrial alterations in fatty liver diseases. J Hepatol 78, 415-429 (2023).5. L. He et al., Proliferation tracing reveals regional hepatocyte generation in liver homeostasis and repair. Science 371, (2021).6. Y. Wei et al., Liver homeostasis is maintained by midlobular zone 2 hepatocytes. Science 371, (2021).7. X. Deng et al., Chronic Liver Injury Induces Conversion of Biliary Epithelial Cells into Hepatocytes. Cell Stem Cell 23, 114-122 e113 (2018).8. W. Pu et al., Bipotent transitional liver progenitor cells contribute to liver regeneration. Nat Genet 55, 651-664 (2023).9. Y. Chen et al., Acute liver steatosis translationally controls the epigenetic regulator MIER1 to promote liver regeneration in a study with male mice. Nat Commun 14, 1521 (2023).https://doi.org/10.1126/science.adj4301
外周脂肪组织分解,产生的脂肪酸通过β-氧化,支持正常肝细胞增殖。线粒体ETC缺失的肝细胞,无法利用脂肪酸,使其堆积,进而抑制丙酮酸到乙酰辅酶A的转化,使其无法增殖。当PDK4被抑制时,线粒体ETC缺失的肝细胞,通过利用丙酮酸来源的乙酰辅酶A进行增殖。(Credit: Science)综上所述,本研究发现肝脏再生过程中,肝脏利用其代谢的不灵活性,通过脂质积累,抑制线粒体ETC功能障碍的肝细胞的增殖,以保护肝脏健康。参考文献1. C. Koliaki et al., Adaptation of hepatic mitochondrial function in humans with non-alcoholic fatty liver is lost in steatohepatitis. Cell Metab 21, 739-746 (2015).2. M. Perez-Carreras et al., Defective hepatic mitochondrial respiratory chain in patients with nonalcoholic steatohepatitis. Hepatology 38, 999-1007 (2003).3. H. Cortez-Pinto et al., Alterations in liver ATP homeostasis in human nonalcoholic steatohepatitis: a pilot study. JAMA 282, 1659-1664 (1999).4. B. Fromenty, M. Roden, Mitochondrial alterations in fatty liver diseases. J Hepatol 78, 415-429 (2023).5. L. He et al., Proliferation tracing reveals regional hepatocyte generation in liver homeostasis and repair. Science 371, (2021).6. Y. Wei et al., Liver homeostasis is maintained by midlobular zone 2 hepatocytes. Science 371, (2021).7. X. Deng et al., Chronic Liver Injury Induces Conversion of Biliary Epithelial Cells into Hepatocytes. Cell Stem Cell 23, 114-122 e113 (2018).8. W. Pu et al., Bipotent transitional liver progenitor cells contribute to liver regeneration. Nat Genet 55, 651-664 (2023).9. Y. Chen et al., Acute liver steatosis translationally controls the epigenetic regulator MIER1 to promote liver regeneration in a study with male mice. Nat Commun 14, 1521 (2023).https://doi.org/10.1126/science.adj4301责编|探索君
排版|探索君
文章来源|“BioArt”
End