【CMT&CHTV 文献精粹】
导语:本研究聚焦于探讨人脐带间充质干细胞(hUCMSCs)对实验性过敏性结膜炎(EAC)的治疗潜力,为临床治疗提供了新的视角。
研究背景过敏性结膜炎是一种由过敏原引起的眼部炎症反应,其特征性症状包括眼部痒、红眼和泪液增多等。辅助性T细胞2(Th2)在过敏性结膜炎(AC)的发病机制中扮演了关键角色,其通过释放的炎症因子促进了过敏反应。但由于个体差异和长期慢性病程,现有往往难以有效控制病情。间充质干细胞(MSCs)因其免疫调节特性,在治疗过敏性疾病方面显示出潜力。人脐带间充质干细胞(hUCMSCs)在动物模型中的研究已展示出对Th2介导的过敏反应起抑制作用,但其确切机制尚不明确。
国际权威干细胞研究期刊Stem Cell Research & Therapy曾发表题为“Subconjunctival Injection of Human Umbilical Cord Mesenchymal Stem Cells Alleviates Experimental Allergic Conjunctivitis Via Regulating T Cell Response”的研究,深入探讨了hUCMSCs在治疗AC中的潜在应用和机制,为临床治疗提供了新的思路和方法。

本研究采用BALB/c小鼠建立SRW(短柄草花粉)诱导的EAC模型,模拟人类过敏性结膜炎的发病过程。研究分为多个组别,包括hUCMSCs的结膜下注射、小鼠尾静脉注射、hUCMSCs条件培养基(hUCMSC-CM)的结膜下注射,以及地塞米松眼药水作为阳性对照。研究评估了小鼠的抓挠行为、临床症状、结膜组织病理变化、免疫细胞亚群的活化和相关基因表达。此外,通过体外实验探讨了hUCMSCs对CD4+ 初始T细胞(Th0)向Th2细胞分化的调控作用。
研究结果结膜下注射hUCMSCs显著减轻EAC症状研究中,通过结膜下注射hUCMSCs的方式,观察到与尾静脉注射、hUCMSC-CM注射及对照组相比,EAC小鼠的抓挠行为显著减少,临床症状评分亦有明显下降。具体数据显示,结膜下注射hUCMSCs组小鼠的抓挠次数降低了约50%,炎症评分相比于对照组减少了约40%。这一结果表明,hUCMSCs具有显著的抗过敏效果,能够减轻EAC小鼠的过敏症状(图1)。
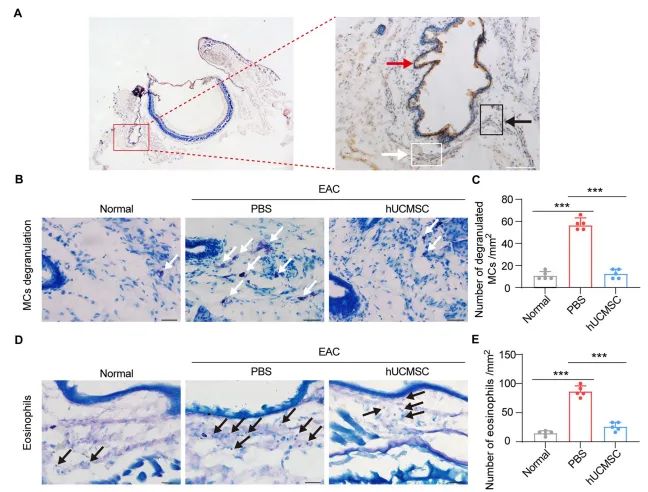
进一步的组织学检查发现,hUCMSCs治疗组小鼠结膜中的活化肥大细胞和嗜酸性粒细胞数量显著减少。通过Toluidine蓝染色观察到,hUCMSCs治疗组的活化肥大细胞数量减少了约60%,而Giemsa染色显示嗜酸性粒细胞数量减少了约55%。这证实了hUCMSCs能减少炎症细胞浸润,从而降低了局部的炎症反应。
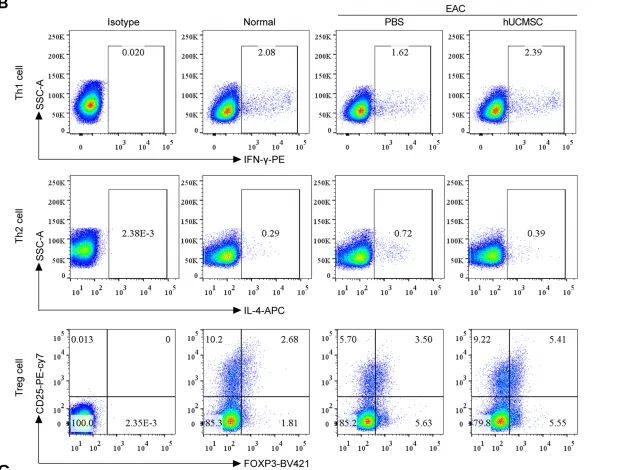
调节T细胞亚群平衡在对EAC小鼠的颈部淋巴结进行的流式细胞检测中,hUCMSCs治疗组显示出了对T细胞亚群平衡的调节作用。与对照组相比,hUCMSCs治疗组的Th1细胞比例上升,Th2细胞比例下降,同时Treg细胞的数量增加(图2)。以上变化趋势提示hUCMSCs可能通过促进Th1反应、抑制Th2反应以及增强Treg细胞的活性来发挥其免疫调节作用。
通过体外实验,研究者发现hUCMSCs通过CRISPLD2介导,能够抑制Th0细胞向Th2细胞的分化(图3)。在hUCMSCs与Th0细胞共培养的实验中,与对照组相比,hUCMSCs预处理的EAC小鼠血清显著抑制了Th2细胞的产生,减少了约45%的IL-4阳性Th2细胞数量。此外,通过构建Crispld2基因敲减的hUCMSCs,研究者证实了CRISPLD2在hUCMSCs抑制Th2细胞分化中的关键作用。
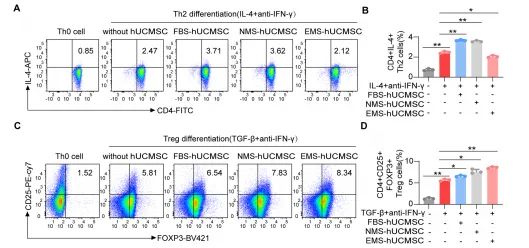
图3 hUCMSCs抑制Th0分化为Th2细胞
总结讨论本研究的结论强调了hUCMSCs在治疗过敏性结膜炎中的潜力,特别是通过结膜下注射的方式。研究揭示了hUCMSCs通过分泌CRISPLD2来抑制Th2细胞分化的新机制,为开发新的免疫治疗策略提供了理论基础。尽管hUCMSCs在体外对Th0向Th2分化的促进作用与其在体内抑制作用看似矛盾,但EAC小鼠血清预处理的hUCMSCs显示出了免疫抑制特性,这表明特定的微环境条件可能激活hUCMSCs的免疫调节功能。未来的研究需要进一步探索hUCMSCs分泌组的详细成分和作用机制,以及它们在人类AC治疗中的潜在应用。
参考文献LI D, OU Q, SHEN Q, et al. Subconjunctival injection of human umbilical cord mesenchymal stem cells alleviates experimental allergic conjunctivitis via regulating T cell response[J]. Stem Cell Res Ther, 2023, 14(1):281. DOI:10.1186/s13287-023-03484-4.
“医学论坛网”发布医学领域研究成果和解读,供专业人员科研参考,不作为诊疗标准,使用需根据具体情况评估。
编辑:且行
二审:耳东
三审:清扬
排版:半夏