
引言
多数癌症在发病率和预后等方面都存在显著的性别差异。癌症的性别差异(Cancer Sex Disparity)通常归因于激素水平和生活方式的不同。2024年8月20日,来自哈佛大学医学院/丹娜-法伯癌症研究所的Srinivas Viswanathan团队(肿瘤医学部)和Cheng-Zhong Zhang团队(数据科学部)在Cell上发表了题为“A genetic basis for cancer sex differences revealed in Xp11 translocation renal cell carcinoma”的学术论文。该研究首次揭示了癌症发病率的性别差异来源于性染色体产生的致癌突变。鲍春旸博士是论文的共同第一作者,并负责DNA拷贝数变异的分析以及肿瘤基因组进化的数据解读。


TFE3基因融合驱动Xp11易位性肾细胞癌的关键突变是位于X染色体上的TFE3基因融合,包括X染色体内部的重组(左),X染色体与常染色体的易位(中)和复杂的基因融合(右)(Credit: Cell)
首先,驱动Xp11易位性肾细胞癌的致癌突变既可以来源于有活性的X染色体(chrXa),也可以来源于失活的X染色体(chrXi)。因此,女性(基因组包含有活性的X染色体和失活的X染色体)比男性(基因组只包含有活性的染色体)发病率更高。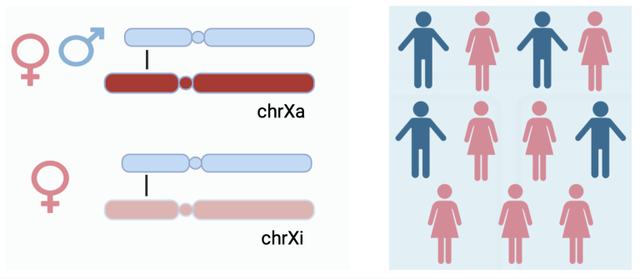
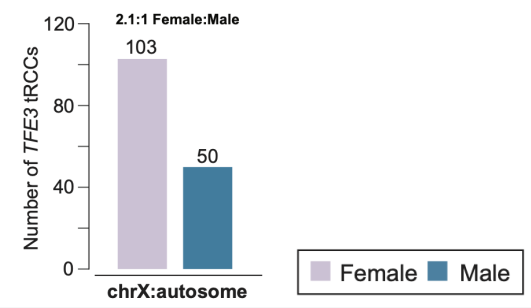
其次,失活的X染色体主要通过与常染色体的易位(translocation)形成TFE3基因融合。对于有活性的X染色体,致癌突变既可以通过X染色体与常染色体之间的易位,也可以通过X染色体内部的重组产生。对于失活的X染色体,要产生致癌突变需要重激活致癌基因。作者推测后者只能通过失活的X染色体常染色体之间的易位来实现。为了验证这一推测,作者收集了203例已有的Xp11易位性肾细胞癌病例,包括复旦大学丁琛课题组的80例和四川大学曾浩课题组的64例。通过分析不同类型的TFE3基因融合,作者发现X染色体与常染色体形成的基因融合在女性和男性中的比例接近2:1。相比之下,X染色体内部重组形成的TFE3基因融合(来源于有活性的X染色体)在女性和男性中的比例接近1:1。上述结果表明,在女性患者中有活性和失活的X染色体参与TFE3基因融合的几率接近1:1。这一发现为解释女性中此类肾癌的高发病率提供了分子生物学依据。此外,作者也在由TFE3基因融合驱动的其他癌症中验证了类似的性别差异。这些发现证实了失活X染色体产生的突变和癌症性别差异之间的直接联系。
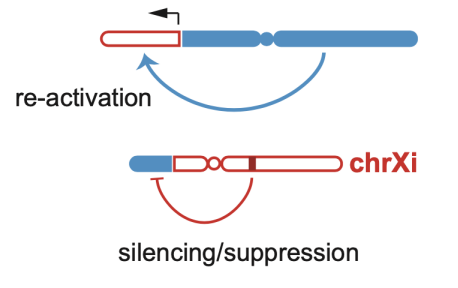
研究进一步发现,失活的X染色体和常染色体共同参与的基因融合会导致相关染色体上出现大范围的转录失调。这种基因融合通过如下机制引发转录失调:在失活的X染色体部分被整合到常染色体上的基因会被重新激活(re-activation);在常染色体上,一部分被整合到失活的X染色体的基因会受到位于X染色体失活特异性转录本(X Inactive Specific Transcript)的调控而沉默(silencing)。
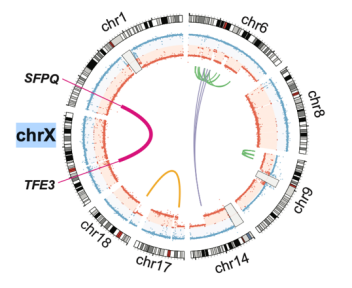
最后,由于X染色体上包含许多必需基因,一旦这些基因的表达丧失,细胞将失去基本的生理功能。因此,在有活性的X染色体上,大片段的DNA缺失是细胞无法耐受的。相反,在失活的X染色体上,大片段的DNA缺失不会对细胞的生理功能产生直接影响,但X染色体与常染色体的重组可以对基因表达甚至细胞的生理功能产生间接影响。该研究首次阐明一个可以解释癌症性别偏差的基因组变异,首次证明一个体细胞变异可以逆转X染色体失活(这一过程在女性胚胎发育期间启动后一直稳定保持)。更广泛地说,失活X染色体产生的突变可能是在其他癌症中性别差异的基础。除了这些进展外,该研究也首次揭示了Xp11易位性肾细胞癌的全基因组特征。
参考文献
https://doi.org/10.1016/j.cell.2024.07.038责编|探索君
排版|探索君
文章来源|“BioArt”
End