*仅供医学专业人士阅读参考

HR+/HER2+早期乳腺癌治疗方案怎么选?
撰文 | Lily随着对肿瘤生物学机制的深入了解和新型药物及疗法的不断创新,“降阶梯”成为近年来肿瘤治疗领域的“热词”。这种全新的治疗策略主要通过“去化疗”来实现治疗优化,降低治疗强度,从而使治疗更安全。HR+/HER2+早期乳腺癌是一种高度异质性的疾病,治疗手段繁杂,化疗联合抗HER2靶向治疗依然是这部分人群的标准治疗方案。尽管内分泌治疗(ET)联合双靶治疗HR+/HER2+乳腺癌十分具有前景,但目前缺乏对比化疗联合双靶的前瞻性研究。既然病理完全缓解(pCR)与预后良好密切相关,那么可否通过新辅助治疗平台筛选出对双靶向联合ET敏感的人群而豁免化疗呢?近日,JAMA Oncology发表的WSG-TP-II研究结果首度正面回答了这一问题,为HR+/HER2+早期乳腺癌的新辅助治疗提供了重要参考。 图1 研究首页截图
图1 研究首页截图降阶化疗 vs 内分泌治疗,
疗效差异显著
WSG-TP-II研究是首个尝试运用ET或降阶化疗联合曲妥珠单抗+帕妥珠单抗双靶治疗用于HR+/HER2+早期乳腺癌新辅助阶段的随机对照前瞻性试验。研究入组了207例HR+/HER2+早期乳腺癌患者,分别接受12周标准ET(n = 100)或紫杉醇80mg/m2单周方案(n = 107),两组均联合曲妥珠单抗+帕妥珠单抗的双靶治疗方案,主要研究终点为pCR率,次要研究终点包括安全性、转化医学研究和患者生活质量(QoL)。 ■ 23.7% vs. 56.4% ,疗效差距显著在疗效方面,ET联合曲妥珠单抗+帕妥珠单抗组(ET组)的pCR率(ypT0/is,ypN0)为23.7%(95% CI,15.7%-33.4%),明显低于紫杉醇联合曲妥珠单抗+帕妥珠单抗组(降阶化疗组)的56.4% (95% CI,46.2%-66.3%) ,差异显著(OR=0.24;95%CI,0.12-0.46;p < 0.001)。 图2 HER2免疫组化0-2+和≥3+患者的pCR率■ 安全性与生活质量,ET组更优安全性方面,两组的耐受性较好。在新辅助治疗期间仅22例患者报告了23 起严重不良事件(AE)(ET组10起, 降阶化疗组13起)。仅报告1起心力衰竭,已缓解(ET组)。ET组和降阶化疗组分别报告5起和30起3-4级AE。在生活质量方面,在新辅助治疗期间,ET组的HRQOL评分稳定,但降阶化疗组显著下降。■ HER2高表达,ET联合双靶治疗仍可纳入选择总的来说,WSG-TP-II研究结果展现了紫杉醇联合曲妥珠单抗+帕妥珠单抗12周治疗新辅助治疗HR+/HER2+早期乳腺癌的出色pCR率,且明显优于内分泌治疗联合曲妥珠单抗+帕妥珠单抗,但不良事件相对较多,对生活质量也有一定的影响。值得注意的是,依然有约24%的患者因术前内分泌治疗联合双靶治疗取得pCR而豁免化疗;转化研究也提示,对于部分完全无法耐受化疗的HR+/HER2+早期乳腺癌患者,如果HER2表达非常高,内分泌治疗联合双靶治疗不失为治疗选择。
图2 HER2免疫组化0-2+和≥3+患者的pCR率■ 安全性与生活质量,ET组更优安全性方面,两组的耐受性较好。在新辅助治疗期间仅22例患者报告了23 起严重不良事件(AE)(ET组10起, 降阶化疗组13起)。仅报告1起心力衰竭,已缓解(ET组)。ET组和降阶化疗组分别报告5起和30起3-4级AE。在生活质量方面,在新辅助治疗期间,ET组的HRQOL评分稳定,但降阶化疗组显著下降。■ HER2高表达,ET联合双靶治疗仍可纳入选择总的来说,WSG-TP-II研究结果展现了紫杉醇联合曲妥珠单抗+帕妥珠单抗12周治疗新辅助治疗HR+/HER2+早期乳腺癌的出色pCR率,且明显优于内分泌治疗联合曲妥珠单抗+帕妥珠单抗,但不良事件相对较多,对生活质量也有一定的影响。值得注意的是,依然有约24%的患者因术前内分泌治疗联合双靶治疗取得pCR而豁免化疗;转化研究也提示,对于部分完全无法耐受化疗的HR+/HER2+早期乳腺癌患者,如果HER2表达非常高,内分泌治疗联合双靶治疗不失为治疗选择。 图3 研究结果总览那下一个问题来了,这接近1/4的可在新辅助治疗免化疗的“幸运儿”,我们怎么提前筛选出来呢?能预测pCR率的HER2DX会不会是未来指导早期HER2+乳腺癌新辅助治疗的“神算子”?JAMA Oncology发表的另一篇最新研究或许能给我们带来启示!
图3 研究结果总览那下一个问题来了,这接近1/4的可在新辅助治疗免化疗的“幸运儿”,我们怎么提前筛选出来呢?能预测pCR率的HER2DX会不会是未来指导早期HER2+乳腺癌新辅助治疗的“神算子”?JAMA Oncology发表的另一篇最新研究或许能给我们带来启示!与pCR率显著相关!
HER2DX可预测新辅助治疗效果
HER2DX基因组检测(Reveal Genomics)是一种已在临床应用的基因分析,使用2个评分来预测早期HER2+阳性乳腺癌的长期预后(即风险评分)和pCR(即pCR评分)的可能性。HER2DX通过对27个基因进行分析,整合临床和生物学信息,从而得到关于免疫缓解、Luminal分型、肿瘤增殖和ERBB2扩增子表达情况的信息。为了确定在治疗基线组织中使用HER2DX是否能够指导基于曲妥珠单抗和化疗联合或不联合帕妥珠单抗在新辅助治疗中的应用,研究团队对GOM-HGUGM-2018-05研究进行了回顾性诊断/预后分析,并与两项先前报道的新辅助队列研究(DAPHNe和I-SPY2)进行了联合分析。 图4 研究首页截图纳入患者均为I-III期HER2+乳腺癌,接受6周期静脉注射多西他赛(75mg/m2,每3周1次)联合静脉注射卡铂(曲线下面积6,每3周一次)加上静脉注射曲妥珠单抗(初始负荷剂量8mg/kg,随后为6mg/kg,每3周一次)(TCH),或在该方案基础上联合静脉注射帕妥珠单抗(初始负荷剂量为840mg,随后为420mg,每3周一次)(TCHP)。本次分析对155名HER2+乳腺癌患者进行了HER2DX检测。HER2DX检测pCR评分低、中、高组的患者分别为53人(34.2%)、54人(34.8%)和48人(31.0%)。整体pCR率为57.4%(95% CI:49.2%-65.2%)。结果显示,GOM队列中HER2DX的pCR评分(范围:0-100)与pCR率显著相关(每增加10个单位,OR增加1.43;95%CI:1.22-1.70;P<0.001)。pCR评分高和pCR评分低组的pCR率分别为75.0%和28.3%(OR=7.85;95%CI:2.67-24.91;P<0.001)。在接受TCHP治疗的患者中,pCR评分高和评分低组pCR率分别为85.7%和27.3%(OR=16.0;95%CI:4.72-67.09;P<0.001)。
图4 研究首页截图纳入患者均为I-III期HER2+乳腺癌,接受6周期静脉注射多西他赛(75mg/m2,每3周1次)联合静脉注射卡铂(曲线下面积6,每3周一次)加上静脉注射曲妥珠单抗(初始负荷剂量8mg/kg,随后为6mg/kg,每3周一次)(TCH),或在该方案基础上联合静脉注射帕妥珠单抗(初始负荷剂量为840mg,随后为420mg,每3周一次)(TCHP)。本次分析对155名HER2+乳腺癌患者进行了HER2DX检测。HER2DX检测pCR评分低、中、高组的患者分别为53人(34.2%)、54人(34.8%)和48人(31.0%)。整体pCR率为57.4%(95% CI:49.2%-65.2%)。结果显示,GOM队列中HER2DX的pCR评分(范围:0-100)与pCR率显著相关(每增加10个单位,OR增加1.43;95%CI:1.22-1.70;P<0.001)。pCR评分高和pCR评分低组的pCR率分别为75.0%和28.3%(OR=7.85;95%CI:2.67-24.91;P<0.001)。在接受TCHP治疗的患者中,pCR评分高和评分低组pCR率分别为85.7%和27.3%(OR=16.0;95%CI:4.72-67.09;P<0.001)。  图5 GOM队列中,HER2+早期乳腺癌患者治疗前基线变量与pCR率间的关联合并分析显示,pCR评分高的患者,使用帕妥珠单抗后pCR率显著增加(OR=5.36;95%CI:1.89-15.20;P<0.001),但在pCR评分低的肿瘤患者中未发现此现象(OR=0.86;95%CI:0.30-2.46;P=0.77)。
图5 GOM队列中,HER2+早期乳腺癌患者治疗前基线变量与pCR率间的关联合并分析显示,pCR评分高的患者,使用帕妥珠单抗后pCR率显著增加(OR=5.36;95%CI:1.89-15.20;P<0.001),但在pCR评分低的肿瘤患者中未发现此现象(OR=0.86;95%CI:0.30-2.46;P=0.77)。 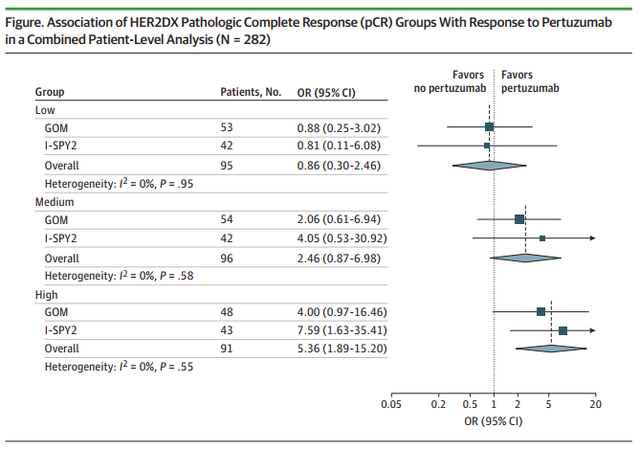 图6 HER2DX pCR评分与帕妥珠单抗疗效的关联这项诊断/预后研究的结果表明,HER2DX检测的pCR评分可以预测早期HER2+乳腺癌患者降阶新辅助紫杉醇联合曲妥珠单抗和帕妥珠单抗治疗后的pCR。通过HER2DX pCR评分确定哪些患者适合降阶或升阶治疗方法,有望为新辅助帕妥珠单抗治疗决策的制订提供指导。精彩资讯等你来参考文献:[1] Gluz O, Nitz UA, Christgen M, et al. Efficacy of Endocrine Therapy Plus Trastuzumab and Pertuzumab vs De-escalated Chemotherapy in Patients with Hormone Receptor–Positive/ERBB2-Positive Early Breast Cancer: The Neoadjuvant WSG-TP-II Randomized Clinical Trial. JAMA Oncol. Published online May 11, 2023. doi:10.1001/jamaoncol.2023.0646[2]Bueno-Muiño C, Echavarría I, López-Tarruella S, et al. Assessment of a Genomic Assay in Patients With ERBB2-Positive Breast Cancer Following Neoadjuvant Trastuzumab-Based Chemotherapy With or Without Pertuzumab. JAMA Oncol. 2023;9(6):841–846. doi:10.1001/jamaoncol.2023.0187本文审核:徐蔚然教授责任编辑:Sheep*医学界力求其发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。
图6 HER2DX pCR评分与帕妥珠单抗疗效的关联这项诊断/预后研究的结果表明,HER2DX检测的pCR评分可以预测早期HER2+乳腺癌患者降阶新辅助紫杉醇联合曲妥珠单抗和帕妥珠单抗治疗后的pCR。通过HER2DX pCR评分确定哪些患者适合降阶或升阶治疗方法,有望为新辅助帕妥珠单抗治疗决策的制订提供指导。精彩资讯等你来参考文献:[1] Gluz O, Nitz UA, Christgen M, et al. Efficacy of Endocrine Therapy Plus Trastuzumab and Pertuzumab vs De-escalated Chemotherapy in Patients with Hormone Receptor–Positive/ERBB2-Positive Early Breast Cancer: The Neoadjuvant WSG-TP-II Randomized Clinical Trial. JAMA Oncol. Published online May 11, 2023. doi:10.1001/jamaoncol.2023.0646[2]Bueno-Muiño C, Echavarría I, López-Tarruella S, et al. Assessment of a Genomic Assay in Patients With ERBB2-Positive Breast Cancer Following Neoadjuvant Trastuzumab-Based Chemotherapy With or Without Pertuzumab. JAMA Oncol. 2023;9(6):841–846. doi:10.1001/jamaoncol.2023.0187本文审核:徐蔚然教授责任编辑:Sheep*医学界力求其发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。