
编者按
转移性去势抵抗性前列腺癌(mCRPC)是前列腺癌的终末阶段,治疗手段有限。随着雄激素受体通路抑制剂(ARSI)以及多腺苷二磷酸核糖聚合酶抑制剂(PARPi)等药物不断取得突破,mCRPC已进入联合治疗与精准治疗时代。然而,仍有若干问题等待我们回答:在缺乏头对头研究的前提下,如何评估不同方案的疗效与安全性?基于免疫检查点抑制剂的联合方案在前列腺癌治疗中是否能有一席之地?本期“益腺学院”聚焦2024年ASCO年会,特邀北京协和医院李永强医生,深入解读mCRPC相关研究,探索mCRPC的治疗策略与前沿进展,并分享其专业见解。
专家简介 李永强北京协和医院泌尿外科 卫健委 副主任医师北京肿瘤学会泌尿肿瘤专业委员会委员中国医师协会微无创专业委员泌尿外科分会委员中国医师协会微无创专业委员会体外冲击波碎石学组委员北京医学奖励基金会泌尿外科专家委员会委员全国卫生产业企业管理协会健康服务适宜技术分会专家委员会委员中国老年学和老年医学学会泌尿和肾病分会委员Abstract 5053 恩扎卢胺 vs. 阿比特龙在真实世界老年mCRPC患者中的有效性与心血管安全性[1]研究背景阿比特龙和恩扎卢胺已广泛用于mCRPC患者的治疗,并已扩展至去势敏感和非转移性疾病的治疗。本研究旨在对比真实世界中老年mCRPC患者首次接受恩扎卢胺vs.阿比特龙治疗的总生存期(OS)和主要不良心血管事件风险(MACE)。研究方法利用美国监测、流行病学和结果(SEER)数据库设计了一项比较性、观察性研究。纳入2011年至2017年间(此时这两种药物仅获批用于mCRPC)开始接受恩扎卢胺或阿比特龙治疗的老年(>65岁)患者。采用倾向性评分和逆概率加权法平衡混杂因素。MACE定义为因心肌梗塞、心衰、缺血性脑卒中或短暂性脑缺血发作住院。采用加权Cox比例风险模型(死亡率)和Fine-and-Gray模型(MACE)评估风险比(HR)。根据衰弱指数分层,探索衰弱状态异质性的影响。 研究结果共纳入5625例首次接受阿比特龙和2933例首次接受恩扎卢胺治疗的患者,中位年龄为76岁。其中70%的患者根据衰弱指数分类为衰弱;约1/3的患者为同时性转移。接受阿比特龙与恩扎卢胺治疗的患者3年OS率相似 (HR=0.97;95% CI 0.90-1.05,详见图1、表1)。按照不同衰弱状态分层后不同治疗组患者的生存结果亦相似(详见表1)。
李永强北京协和医院泌尿外科 卫健委 副主任医师北京肿瘤学会泌尿肿瘤专业委员会委员中国医师协会微无创专业委员泌尿外科分会委员中国医师协会微无创专业委员会体外冲击波碎石学组委员北京医学奖励基金会泌尿外科专家委员会委员全国卫生产业企业管理协会健康服务适宜技术分会专家委员会委员中国老年学和老年医学学会泌尿和肾病分会委员Abstract 5053 恩扎卢胺 vs. 阿比特龙在真实世界老年mCRPC患者中的有效性与心血管安全性[1]研究背景阿比特龙和恩扎卢胺已广泛用于mCRPC患者的治疗,并已扩展至去势敏感和非转移性疾病的治疗。本研究旨在对比真实世界中老年mCRPC患者首次接受恩扎卢胺vs.阿比特龙治疗的总生存期(OS)和主要不良心血管事件风险(MACE)。研究方法利用美国监测、流行病学和结果(SEER)数据库设计了一项比较性、观察性研究。纳入2011年至2017年间(此时这两种药物仅获批用于mCRPC)开始接受恩扎卢胺或阿比特龙治疗的老年(>65岁)患者。采用倾向性评分和逆概率加权法平衡混杂因素。MACE定义为因心肌梗塞、心衰、缺血性脑卒中或短暂性脑缺血发作住院。采用加权Cox比例风险模型(死亡率)和Fine-and-Gray模型(MACE)评估风险比(HR)。根据衰弱指数分层,探索衰弱状态异质性的影响。 研究结果共纳入5625例首次接受阿比特龙和2933例首次接受恩扎卢胺治疗的患者,中位年龄为76岁。其中70%的患者根据衰弱指数分类为衰弱;约1/3的患者为同时性转移。接受阿比特龙与恩扎卢胺治疗的患者3年OS率相似 (HR=0.97;95% CI 0.90-1.05,详见图1、表1)。按照不同衰弱状态分层后不同治疗组患者的生存结果亦相似(详见表1)。 图1. 两组患者3年OS生存分析表1. 根据不同衰弱状态分层的患者OS风险分析
图1. 两组患者3年OS生存分析表1. 根据不同衰弱状态分层的患者OS风险分析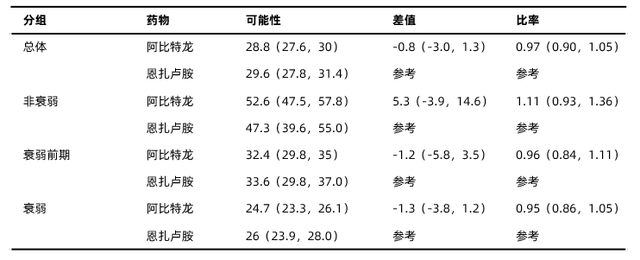 与恩扎卢胺相比,接受阿比特龙治疗的患者1年MACE风险较高(HR=1.26;95% CI 1.02-1.59,详见图2、表2),衰弱程度更高的患者MACE风险比值(阿比特龙 vs. 恩扎卢胺)更高(详见表2)。
与恩扎卢胺相比,接受阿比特龙治疗的患者1年MACE风险较高(HR=1.26;95% CI 1.02-1.59,详见图2、表2),衰弱程度更高的患者MACE风险比值(阿比特龙 vs. 恩扎卢胺)更高(详见表2)。 图2. 两组患者1年MACE风险分析表2. 根据不同衰弱状态分层的患者MACE风险分析
图2. 两组患者1年MACE风险分析表2. 根据不同衰弱状态分层的患者MACE风险分析 研究结论研究结果显示,尽管两组患者生存结果相当,但接受阿比特龙治疗的患者的1年MACE风险升高26%。此外,衰弱患者的MACE风险比值(阿比特龙 vs. 恩扎卢胺)更高,提示在为老年患者选择治疗方案时评估衰弱状态的重要性。李永强医生点评mCRPC是前列腺癌的终末阶段,生存预后较差。PREVAIL研究[2]和COU-AA 302研究[3]分别证实了恩扎卢胺和阿比特龙在mCRPC中的治疗价值,恩扎卢胺和阿比特龙也作为指南推荐的mCRPC一线治疗药物,广泛应用于临床。但目前尚无头对头比较各种新型内分泌药物(NHT)的前瞻性随机对照试验,无法直接比较其疗效和安全性,因此研究者尝试用真实世界数据或者网状荟萃分析等方法间接比较不同药物的表现。本次大会摘要5053利用美国SEER数据库的数据,通过比较显示恩扎卢胺和阿比特龙在老年mCRPC患者中的3年OS率相当。我们在临床中为患者选择药物的时候,除了参考这些研究中的疗效数据,也会充分考虑不同药物的不良反应谱、药物相互作用、患者的基础疾病和状态等因素。其中雄激素剥夺治疗(ADT)和NHT的心血管风险是值得特别关注的,且心血管疾病是老年前列腺癌患者最常见的共病负担之一,也是其非癌症死亡的重要原因。本研究也比较了两种药物的MACE风险,结果显示,与恩扎卢胺相比,接受阿比特龙治疗的mCRPC老年患者一年内发生MACE的风险升高26%。我们还注意到本研究一个特别的地方,它将患者根据衰弱指数分层,比较了在不同衰弱状态的患者中两种药物的影响。我们知道,临床试验的患者是经过严格筛选的,而真实世界中的患者往往年龄更大,身体条件更差,基础疾病和合并用药也更多。衰弱指数是一种包括躯体、功能、心理及社会等多维度变量的指标,可以反应老年患者的总体健康状况[4]。本研究根据患者衰弱状态分层后分析显示,虽然两种药物的OS仍无差异,但在不同衰弱状态的患者中两种药物的MACE风险相对值则不同,在衰弱状态更差的患者中阿比特龙相对恩扎卢胺的MACE风险更高。这提示我们在老年前列腺癌患者的诊疗中,要重视评估患者的整体健康水平,例如衰弱状态,以便为其选择合适的治疗策略。Abstract 5063 Talazoparib+恩扎卢胺(TALA+ENZA) vs. 奥拉帕利+阿比特龙+泼尼松/泼尼松龙(OLAP+AAP)作为携带同源重组修复突变(HRRm)/BRCAm的mCRPC患者一线治疗的校正间接比较(MAIC)[5]
研究结论研究结果显示,尽管两组患者生存结果相当,但接受阿比特龙治疗的患者的1年MACE风险升高26%。此外,衰弱患者的MACE风险比值(阿比特龙 vs. 恩扎卢胺)更高,提示在为老年患者选择治疗方案时评估衰弱状态的重要性。李永强医生点评mCRPC是前列腺癌的终末阶段,生存预后较差。PREVAIL研究[2]和COU-AA 302研究[3]分别证实了恩扎卢胺和阿比特龙在mCRPC中的治疗价值,恩扎卢胺和阿比特龙也作为指南推荐的mCRPC一线治疗药物,广泛应用于临床。但目前尚无头对头比较各种新型内分泌药物(NHT)的前瞻性随机对照试验,无法直接比较其疗效和安全性,因此研究者尝试用真实世界数据或者网状荟萃分析等方法间接比较不同药物的表现。本次大会摘要5053利用美国SEER数据库的数据,通过比较显示恩扎卢胺和阿比特龙在老年mCRPC患者中的3年OS率相当。我们在临床中为患者选择药物的时候,除了参考这些研究中的疗效数据,也会充分考虑不同药物的不良反应谱、药物相互作用、患者的基础疾病和状态等因素。其中雄激素剥夺治疗(ADT)和NHT的心血管风险是值得特别关注的,且心血管疾病是老年前列腺癌患者最常见的共病负担之一,也是其非癌症死亡的重要原因。本研究也比较了两种药物的MACE风险,结果显示,与恩扎卢胺相比,接受阿比特龙治疗的mCRPC老年患者一年内发生MACE的风险升高26%。我们还注意到本研究一个特别的地方,它将患者根据衰弱指数分层,比较了在不同衰弱状态的患者中两种药物的影响。我们知道,临床试验的患者是经过严格筛选的,而真实世界中的患者往往年龄更大,身体条件更差,基础疾病和合并用药也更多。衰弱指数是一种包括躯体、功能、心理及社会等多维度变量的指标,可以反应老年患者的总体健康状况[4]。本研究根据患者衰弱状态分层后分析显示,虽然两种药物的OS仍无差异,但在不同衰弱状态的患者中两种药物的MACE风险相对值则不同,在衰弱状态更差的患者中阿比特龙相对恩扎卢胺的MACE风险更高。这提示我们在老年前列腺癌患者的诊疗中,要重视评估患者的整体健康水平,例如衰弱状态,以便为其选择合适的治疗策略。Abstract 5063 Talazoparib+恩扎卢胺(TALA+ENZA) vs. 奥拉帕利+阿比特龙+泼尼松/泼尼松龙(OLAP+AAP)作为携带同源重组修复突变(HRRm)/BRCAm的mCRPC患者一线治疗的校正间接比较(MAIC)[5]研究背景
PARPi联合NHT作为mCRPC的一线治疗已在全人群和HRRm/BRCAm人群(TALA+ENZA [TALAPRO-2;NCT03395197],OLAP+AAP[PROpel;NCT03732820])中显示出获益。然而由于缺乏头对头研究,两种方案的疗效对比尚不明确。本研究旨在通过盲态独立中心评估的影像学无进展生存期(rPFS)和OS的MAIC评估TALA+ENZA(n=200 HRRm;n=71 BRCAm) vs. OLAP+AAP(n=111 HRRm;n=47 BRCAm)在HRRm/BRCAm人群中的相对疗效。
研究方法
对TALAPRO-2研究队列2中的个体患者数据(截至2022年10月3日[rPFS/OS])和PROpel研究发表的汇总数据(截至2021年7月30日[rPFS];2022年10月12日[OS])进行非锚定MAIC分析。为保持两项研究的一致性,在每项分析中删除了在TALAPRO-2研究中具有特定HRRm/BRCAm(共同或单独存在)但PROpel研究中未评估的患者。根据PROpel研究的纳入标准对TALAPRO-2研究的患者进行匹配,并对关键预后因素进行校正,这些因素是根据文献和临床专家意见确定的,包括:去势敏感阶段(HSPC)接受过紫杉烷类化疗、内脏转移、仅骨转移、ECOG评分、前列腺特异性抗原(PSA)水平、Gleason评分、BRCA1和BRCA2突变。通过逐步校正一个额外的变量进行敏感性分析,进一步校正BRCA1和BRCA2进行探索性分析。计算有效样本量(ESS)和标准化均值差(SMD)以分别显示调整后的TALA+ENZA和OLAP+AAP人群的重叠程度和差异。
研究结果
在HRRm人群中,主要分析显示,TALA+ENZA组的rPFS数值(HR=0.668,95% CI 0.429-1.041,P=0.074)和OS数值(HR=0.663,95% CI 0.406-1.082,P=0.100)均优于OLAP+AAP组。敏感性分析和探索性分析的结果与主要分析一致,但均无统计学差异,详见图3、图4。

图3. HRRm人群中两组的rPFS生存曲线(上)和森林图(下)
 图4. HRRm人群中两组的OS生存曲线(上)和森林图(下)
图4. HRRm人群中两组的OS生存曲线(上)和森林图(下)

图5. BRCAm人群中两组的rPFS生存曲线(上)和森林图(下)
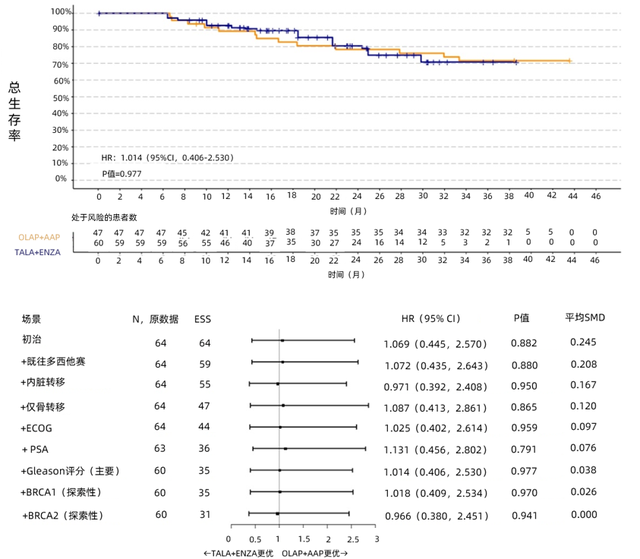
图6. BRCAm人群中两组的OS生存曲线(上)和森林图(下)
研究结论
以上分析显示, TALA+ENZA的rPFS和OS结果较OLAP+AAP在数值上更优,这表明其在HRRm和BRCAm mCRPC患者一线治疗中的潜力。
李永强医生点评mCRPC阶段的治疗选择有限,近年来PARPi作为二线以上单药治疗和一线联合治疗开展了众多试验,取得了长足的发展。NHT可通过诱发HRR缺陷表型对PARPi增敏,增强PARPi的效果,同时PARPi也可以间接抑制雄激素受体功能,与NHT产生协同作用,这也是两者联合达到“1+1>2”的理论基础[6,7]。PROpel研究[8]和TALAPRO-2研究[9]证实在NHT的基础上联合PARPi在HRRm/BRCAm人群中作为一线治疗的获益,并已被EAU等指南推荐[10]。目前国内外已获批多种PARPi和NHT,不同联合方案的疗效是否存在差异?目前尚无头对头的研究解答这一问题,而本次大会摘要5063通过匹配PROpel和TALAPRO-2研究中的单个患者,并进行多种因素的校正,对两种方案进行了间接比较,结果显示,二者的rPFS和OS风险比虽然有数值上的差异,但并无统计学差异。这或许提示基于目前的研究,不同方案间的疗效差异并不显著。当然,这样的匹配校正间接比较的混杂因素和偏倚较多,其结果只能作为参考,我们期待未来更多的研究和数据为我们解答这些问题。
但同时,我们也发现,在HRRm和BRCAm的不同突变类型的人群中,两种方案的获益趋势和数值相对大小存在一定差异,这也提示我们前列腺癌的精准治疗还有很多值得深挖的方向。PARPi作为前列腺癌中难得的靶向药物,我们期待有更多患者能从中获益,同时也希望能精准识别和区分适合PARPi治疗的患者。这就需要一方面开展更多的临床研究,探索PARPi在不同人群、不同疾病阶段和不同联合方案中的潜力;另一方面不断完善基因检测的生物标志物和方法,最大化这类靶向药物的获益。
Abstract 5064 KEYLYNK-010研究中与结局相关的生物标志物:帕博利珠单抗(Pembro)+奥拉帕利(Ola) vs. 新型内分泌药物(NHA)用于既往经治的mCRPC患者 [11]研究背景
在KEYLYNK-010(NCT03834519)III期研究中,Pembro+Ola vs. NHA并未显著改善未经选择的既往经治的mCRPC患者的rPFS和OS。本次报告了根据预设的生物标志物分析的rPFS和OS结果。
研究方法
患者按2:1随机分配至Pembro+Ola或NHA组。采用免疫组织化学法(22C3 pharmDx试剂盒)测定程序性死亡受体-1配体(PD-L1)综合阳性评分(CPS);采用FoundationOne CDx分析组织样本或采用FoundationOne Liquid CDx分析循环肿瘤DNA样本检测HRRm、BRCAm、TP53、PTEN、SPOP、ATM、CDK12、肿瘤突变负荷(TMB)和微卫星不稳定性(MSI),采用Epic Sciences循环肿瘤细胞分析雄激素受体剪接变异体7(AR-V7)。采用校正Cox比例风险回归模型评估与结局之间的相关性,计算单侧P值(Pembro+Ola)和双侧P值(NHA),假设显著性α<0.05。在有足够样本量的生物标志物亚组分析中,评估Pembro+Ola vs. NHA的rPFS和OS的HR。
研究结果
在具有不同可评估的生物标志物的患者中,27.6%携带HRRm,10.4%携带BRCAm,44.8%携带TP53m,34.3%携带PTENm,8.5%携带SPOPm,7.0%携带ATMm,6.5%携带CDK12m,4.3%为高TMB(≥10mut/Mb),1.9%为高MSI,13.1%为AR-V7阳性。在Pembro+Ola组中,仅观察到PD-L1 CPS与rPFS之间(P=0.03),HRRm与rPFS之间(P=0.003)和BRCAm与rPFS之间(P<0.001)呈正相关。在NHA组中未观察到相关性(全部P>0.05)。不同生物标志物状态亚组中Pembro+Ola vs. NHA的rPFS和OS的HR参见表3,其中AR-V7状态的结果值得关注。表3. 选定的生物标志物与经治患者临床结局的关系

研究结论
对于Pembro+Ola,PD-L1 CPS与rPFS呈弱正相关,HRRm和BRCAm与rPFS呈强正相关,这些生物标志物与NHA的治疗结局无相关性。对于AR-V7阳性的mCRPC患者,Pembro+Ola较NHA在rPFS和OS方面有潜在获益趋势,仍需进一步验证。
李永强医生点评在过去十年中,以PD-1/PD-L1为代表的免疫检查点抑制剂无疑是肿瘤治疗领域最大的突破之一,其在众多瘤种中大放异彩,改写了治疗格局。但很遗憾的是,其在前列腺癌领域却似乎始终不得志,从最早的单药治疗到后面联合NHT、化疗、PARPi等不同作用机制且已在前列腺癌广泛应用的药物,大多仅展现了有限的疗效,始终无法取得突破。KEYLYNK-010研究也是诸多折戟沉沙,获得阴性结果的III期试验之一。与NHT相比,Pembro+Ola并未改善既往经治mCRPC患者的rPFS和OS[12]。造成这些结果的原因主要由于前列腺癌整体TMB较低,肿瘤微环境亦不利于免疫细胞的浸润和激活,被认为是免疫“冷”肿瘤。如何使其“热”起来,或筛选其中较“热”的患者则一直是科学家和临床专家共同研究的重点。
KEYLYNK-010纳入的是未经任何生物标志物筛选的患者,本次大会摘要5064则报道了其中不同生物标志物状态与治疗结局的关系,结果显示,PD-L1 CPS、HRRm及BRCAm与Pembro+Ola治疗组的rPFS正相关,这提示未来或许可在经这些生物标志物筛选的患者中继续研究PD-1/PD-L1+PARPi的作用。更加值得关注的是,在AR-V7阳性的患者中,Pembro+Ola较NHA在rPFS和OS方面有潜在获益趋势。AR-V7是已知与NHT抵抗相关的突变,AR-V7阳性的患者对NHT的响应往往较差[13],这类患者存在较大的未满足的治疗需求,免疫+靶向治疗的组合在这类患者中的潜力或许值得继续探索。期待未来随着基础研究、分子诊断、临床研究的共同努力和进步,我们终能找到合适的方案并在合适的患者中应用,让免疫治疗在前列腺癌的治疗中真正获得一席之地,为mCRPC患者带来新的治疗希望。
小结
联合是基础,精准是未来。在前列腺癌联合治疗与精准治疗的时代背景下,生物标志物、基因检测等手段为前列腺癌的分型、治疗和预后管理提供重要指导。我们期待未来mCRPC领域取得更大的突破,更多新药、新治疗方案可为mCRPC患者带来新的选择和希望。同时对患者做更精细化的评估和管理,切实改善其生存和生活质量。
参考文献
[1] GABER C, OKPARA E, ABDELAZIZ A, et al. Real-world comparative effectiveness and cardiovascular safety of enzalutamide versus abiraterone amongst older men diagnosed with metastatic castration-resistant prostate cancer.[J/OL]. Journal of Clinical Oncology, 2024, 42(16_suppl): 5053-5053.
[2] Beer TM, Armstrong AJ, Rathkopf DE, et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med. 2014 Jul 31;371(5):424-33.
[3] Ryan CJ, Smith MR, Fizazi K, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol. 2015 Feb;16(2):152-60.
[4] 中华医学会老年医学分会. 老年患者衰弱评估与干预中国专家共识. 中华老年医学杂志, 2017,36(03) : 251-256.
[5] CASTRO E, WANG D, HALTNER A, et al. Matching-adjusted indirect comparisons (MAICs) of talazoparib plus enzalutamide (TALA+ENZA) versus olaparib plus abiraterone and prednisone/prednisolone (OLAP+AAP) for first-line (1L) therapy in patients with metastatic castration-resistant prostate cancer (mCRPC) and homologous recombination repair mutations (HRRm)/BRCAm.[J/OL]. Journal of Clinical Oncology, 2024, 42(16_suppl): 5063-5063.
[6] Gui B, Gui F, Takai T, et al. Selective targeting of PARP-2 inhibits androgen receptor signaling and prostate cancer growth through disruption of FOXA1 function. Proc Natl Acad Sci U S A. 2019 Jul 16;116(29):14573-14582.
[7] Asim M, Tarish F, Zecchini HI, et al. Synthetic lethality between androgen receptor signalling and the PARP pathway in prostate cancer. Nat Commun. 2017 Aug 29;8(1):374.
[8] Saad F, Clarke NW, Oya M, et al. Olaparib plus abiraterone versus placebo plus abiraterone in metastatic castration-resistant prostate cancer (PROpel): final prespecified overall survival results of a randomised, double-blind, phase 3 trial. Lancet Oncol. 2023 Oct;24(10):1094-1108.
[9] Agarwal N, Azad AA, Carles J, et al. Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial. Lancet. 2023 Jul 22;402(10398):291-303.
[10] Cornford P, van den Bergh RCN, Briers E, et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG Guidelines on Prostate Cancer-2024.
[11] YU E Y, PARK S H, GOH J C, et al. Biomarkers associated with outcomes from KEYLYNK-010: Pembrolizumab (pembro) plus olaparib (ola) versus next-generation hormonal agent (NHA) in previously treated metastatic castration-resistant prostate cancer (mCRPC).[J/OL]. Journal of Clinical Oncology, 2024, 42(16_suppl): 5064-5064.
[12] Antonarakis ES, Park SH, Goh JC, et al. Pembrolizumab Plus Olaparib for Patients With Previously Treated andBiomarker-Unselected Metastatic Castration-Resistant Prostate Cancer: The Randomized, Open-Label, Phase III KEYLYNK-010 Trial. J Clin Oncol. 2023 Aug1;41(22):3839-3850.
[13] Antonarakis ES, Lu C, Wang H, et al. AR-V7 and resistance to enzalutamide and abiraterone in prostate cancer. N Engl J Med. 2014 Sep 11;371(11):1028-38.
声明
本视频/资讯/文章是由益普生医学团队编辑/医疗卫生专业人士撰写提供,旨在用于医疗卫生专业人士间的学术交流,不支持以任何形式转发给非医疗卫生专业人士;如有违反,责任自负;转发给其他医疗卫生专业人士时,也请自觉保护知识产权。
本视频/资讯/文章的内容不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。内容中出现任何药品并非为广告推广目的,医疗卫生专业人士如进行处方,请严格遵照该药品在中国批准使用的说明书。益普生不承担任何相关责任。
DIP-CN-012266 有效期至2025年6月27日
编辑:Rudolf
审核:Nobody
排版:Gardenia
执行:Gardenia
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。
