文章来源:BioLegend生物科学分享平台
流式细胞术是最早在上世纪50年代开发的一项用于对单个细胞表型鉴定和功能分析的工具,可以从异质型群体中找到单个细胞的独特特征。如今大火的单细胞测序,多多少少是借鉴了流式细胞术的设计理念。使用流式细胞术,研究者们可以测量细胞的大小,内容物颗粒度,判定细胞的死活状态,细胞周期以及蛋白的表达情况,现如今是一种非常经典的免疫学研究工具。
荧光原理
在研究中使用的荧光素包括荧光蛋白(藻红蛋白PE,别藻蓝蛋白APC等),也包括一些合成荧光物质(Spark系列荧光素)。这些荧光物质都可以吸收特定波长的光源,然后发射出波长更长的光信号。如下图所示,每一种荧光素都有独特的吸收光谱和发射光谱;
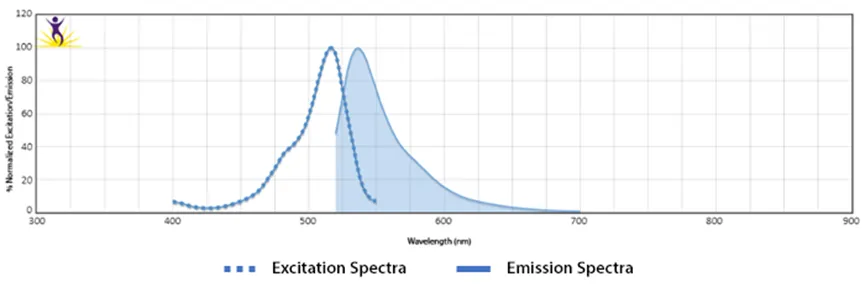
图1.Spark Blue™️ 550的吸收光谱和发射光谱
在荧光素吸收和发射光的过程中,实际上是荧光素的电子吸收了光子的能量,吸收的能量又必须释放使得电子回到基态。在能量释放的过程中,部分能量以热能的形式被消耗,这样就使得释放的光子能量比被吸收的光子能量要低,所以释放出的光的波长更长,能量更低。其结果就是释放出的能量的“颜色”会不一样。其示意图如下图所示:
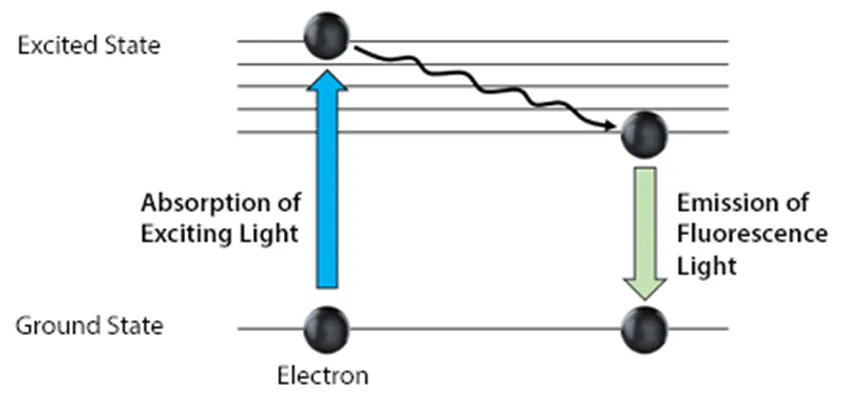
图2. Jablonski 示意图
荧光素的最大吸收波长和最大发射波长之间红移,称为斯托克斯位移,如图1所示。那些具有更大斯托克斯位移的荧光素常具有更小的背景荧光,在多色流式panel设计中往往具有更好的适用性。
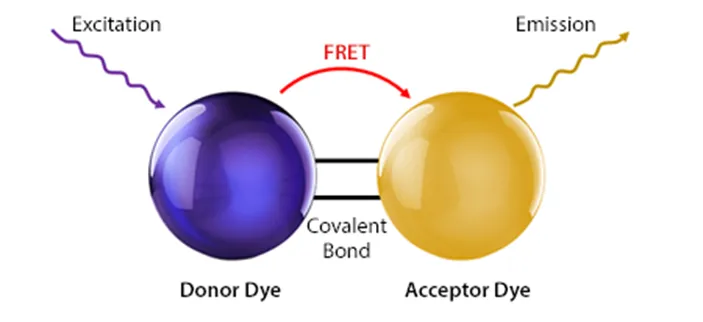
偶联荧光素往往具有很大的斯托克斯位移,它们由两种共价结合的荧光素组成,一种称为供体一种称为受体,由供体的发射光,通过荧光能量共振转移(fluorescenceresonance energy transfer,FERT)模型,成为了受体的激发光,从而激发了受体荧光素的新荧光。
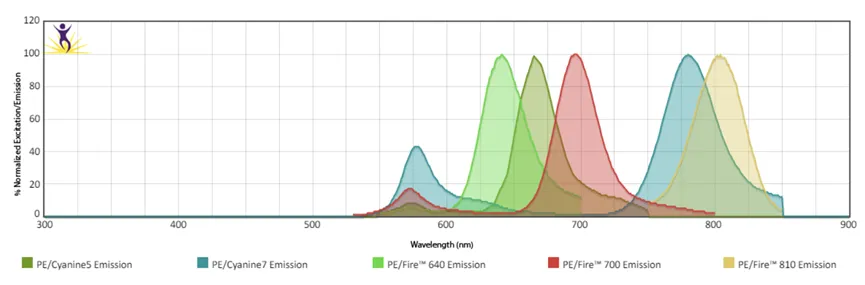
如下图所示,PE-Cy5是一种由PE和Cy5组成的偶联荧光素,其激发光谱和PE有很大部分的重叠,而发射光谱几乎和Cy5一致:
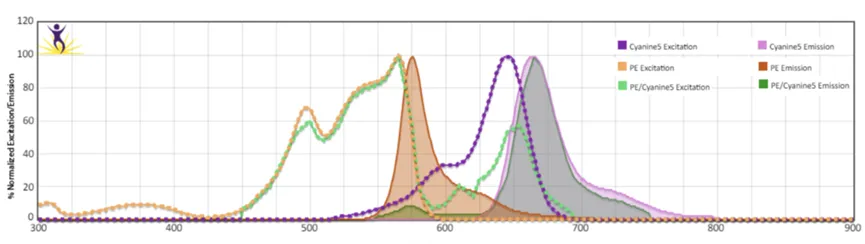
所以,将偶联荧光素应用到流式细胞术中,可以使用单一的激光,激发出多种不同发射波长的荧光,比如常见的561nm激光器,可以激发出PE-Cy7,PE-Cy5,PE/Fire™ 700,PE/Fire™ 640 , PE/Fire™ 810等一系列由PE及相应受体组成的偶联荧光素,他们的发射波长范围从600+nm一直分布到800+nm波长的远红外段,大大地拓展了流式细胞术一次实验中可以检测的指标数量。
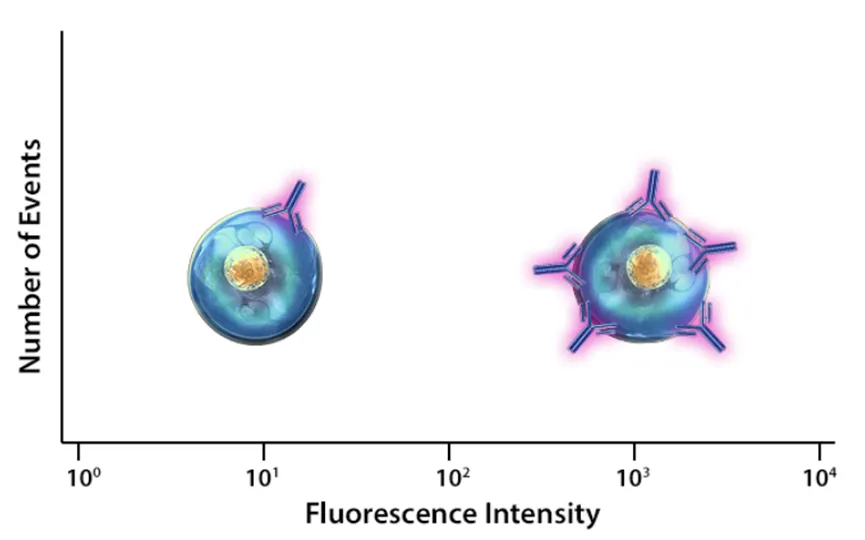
亮度
荧光亮度,可以通过摩尔消光系数和量子产率来描述,前者指的是光在特定波长下被吸收的多少,后者指的是发射的光子数量和吸收的光子数量之比。抗体的荧光亮度受多种因素影响,其中之一就是荧光素/抗体比例(fluorophore:protein(F:P) ratio)。F:P 值和荧光素大小以及荧光标记方法有关,通常小分子的荧光素可以更多地结合到抗体上。另外,被标记的细胞荧光的强弱,和该细胞上相应抗原的表达强度有关,表达丰度越高,更多的抗体可以结合到细胞上,细胞更“亮”,如下图所示:
影响流式抗体“亮度”的因素还包括抗体亲和力,仪器激光器的激发波长,激光器效率等,为了统一“度量衡”,我们在厂内使用不同荧光素,全部去偶联相同克隆的CD4抗体,然后用相同浓度的抗体对PBMC样品进行细胞标记,最后在流式细胞仪上收集对应的荧光信号。通过计算并比较各种荧光素的SI值(stain index, 计算方法如下图所示):
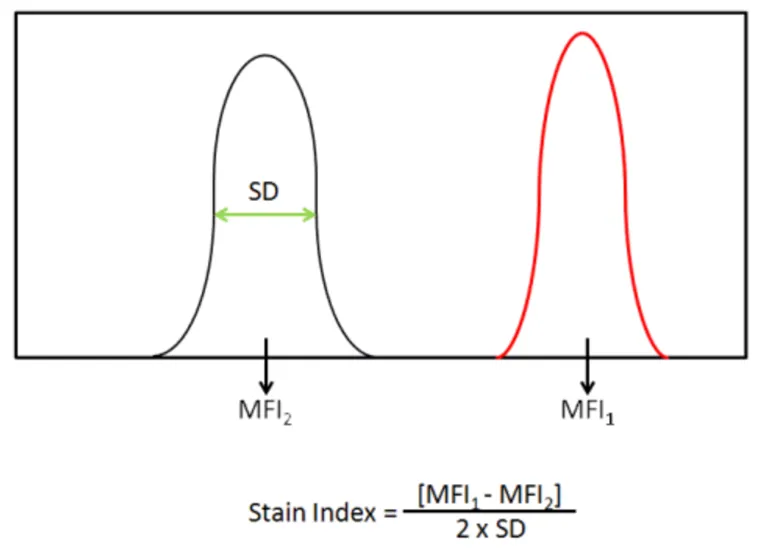
这样就可以知道某一种荧光素的“亮度”。我们测试了所有BioLegend在售的荧光素的亮度,并且按照强弱,从1到5的相对亮度进行排序,1代表荧光素‘亮度‘较弱,5代表荧光素’亮度‘很强,在进行流式panel design的时候就可以利用这样的强弱来搭配不同的检测指标。
本期先到这里啦!敬请期待下一期。
