迄今为止,卡瑞利珠单抗在国内已获批9个适应症。
撰文 | 小驰2023年1月31日,恒瑞医药宣布,旗下产品卡瑞利珠单抗(艾瑞卡)联合阿帕替尼(艾坦)晚期肝癌一线治疗适应症获国家药品监督管理局(NMPA)批准上市。

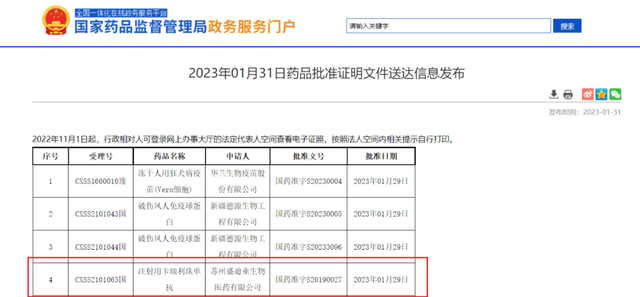
NMPA截图
卡瑞利珠单抗为一种人源化抗PD-1单克隆抗体,此前已在肺癌、肝癌、食管癌、鼻咽癌以及淋巴瘤五大瘤种中获批8个适应症,且均已纳入国家医保药品目录。阿帕替尼是一款针对血管内皮生长因子受体(VEGFR)的小分子酪氨酸激酶抑制剂,目前有2个适应症获批,分别针对晚期胃腺癌或胃-食管结合部腺癌、晚期肝细胞癌。
本次新适应症获批,是基于SHR-1210-Ⅲ-310研究[1]取得的突破结果。2022年欧洲肿瘤内科学会(ESMO)年会上,该研究作为突破性摘要(LBA)进行口头报告,广受关注。
SHR-1210-Ⅲ-310研究是一项随机对照、开放标签、国际多中心Ⅲ期临床试验,旨在评估卡瑞利珠单抗联合阿帕替尼对比索拉非尼治疗既往未接受过系统治疗的不可切除或转移性肝细胞癌患者有效性和安全性。该研究覆盖了全球13个国家与地区的95家研究中心,共纳入543例既往未接受过系统治疗的晚期肝癌患者。受试者按照1:1的比例随机分配,分别接受“双艾”方案治疗或索拉非尼单药治疗。
结果表明,对比索拉非尼一线治疗方案,“双艾”方案能显著延长晚期肝癌患者的无进展生存期(PFS)与总生存期(OS)。中位随访时间7.8个月时,“双艾”治疗组的中位PFS为5.6个月,中位OS为22.1个月,相对于索拉非尼组,疾病进展或死亡风险降低 48.0%,患者死亡风险降低38%。
基于该研究结果,2022版中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南已将“双艾”方案列入肝癌的一线治疗方案(1A类证据,Ⅰ级专家推荐)[2]。
据统计,全球每年新发肝癌病例数约为90.57万,每年死亡病例数约为83.02万,在所有肿瘤中高居第三[3]。中国新发肝癌病例和死亡患者约占全球半数[4]。肝癌起病隐匿,进展迅速,许多患者在初诊时即诊断为中晚期肝癌,无法接受手术治疗,亟需系统药物。“双艾”组合是中国首个获批用于治疗晚期肝细胞癌的PD-1抑制剂与小分子抗血管生成药物组合,为晚期肝癌患者带来了新的治疗选择。
除了肝癌外,“双艾”组合还在黑色素瘤、鼻咽癌、头颈肿瘤、肺癌、胰腺癌等领域的临床研究中取得积极进展。多项研究成果入选2022年美国临床肿瘤学会(ASCO)年会[5]与2022欧洲肿瘤内科学会学(ESMO)年会等国际顶尖学术会议[6]。
更多肿瘤前沿内容快来“医生站网页版”瞧一瞧👇长按识别二维码或点击阅读原文精彩资讯等你来参考文献:
[1]S. Qin, L.S. Chan, S. Gu,et al.Camrelizumab (C) plus rivoceranib (R) vs. sorafenib (S) as first-line therapy for unresectable hepatocellular carcinoma(uHCC): A randomized, phase III trial.2022ESMO.LBA35.
[2]中国临床肿瘤学会指南工作委员会. 原发性肝癌诊疗指南(2022)[M]. 北京:人民卫生出版社,2022.
[3]Hyuna Sun, Jacques Ferlay, Rebecca L. Siegel, et al. Global Cancer Statistics 2020. CA CANCER J CLIN.2021;71:209-249
[4]中国临床肿瘤学会指南工作委员会. 原发性肝癌诊疗指南(2020)[M]. 北京:人民卫生出版社,2020.
[5]https://www.hengrui.com/media/detail-213.html《2022 ASCO年会开幕,恒瑞医药抗肿瘤创新药的60多项研究亮相国际学术舞台》
[6]https://www.hengrui.com/media/detail-255.html《2022ESMO开幕|恒瑞医药创新药的29项研究再登国际学术盛会,展示抗肿瘤领域中国自主创新成果》
本文首发:医学界肿瘤频道
责任编辑:XU*医学界力求其发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。