同卵双胞胎是自然生育过程中一种相对常见的现象,指的是一个受精卵在早期分裂成两个胚胎,最终发育成两个基因完全相同的个体。与异卵双胞胎不同,后者是由于两个卵子分别受精形成的,基因上并不完全相同。基因解码致力于同卵双胞胎的形成机制,从基因的角度理解为什么会产生同卵双胞胎。
基因解码技术正在致力于从分子层面深入探讨同卵双胞胎的基因本质。通过全基因组测序和比较分析,科学家们发现,同卵双胞胎的形成可能与特定基因变异和基因表达模式的变化有关。基因解码的研究表明,遗传因素可能在决定胚胎是否分裂、分裂的时间等方面起到一定作用。此外,环境因素如母体健康、激素水平等,也可能对同卵双胞胎的形成产生影响。
人们认为同卵双胞胎 (MZ) 是由一个受精胚胎在不同阶段分裂而产生的。佳学基因在分析同卵双胞胎的过程中,将同卵双胞胎又分为单绒毛膜同卵双胞胎(MZ双胞)共用一个绒毛膜,起源于单个囊胚内的内细胞团 (ICM) 分裂。在双绒毛膜同卵双胞胎(MZ双胞)的经典模型中,胚胎在紧密化之前分裂,发育成两个囊胚。然而,越来越多的辅助生殖技术(ART)病例中,单囊胚移植导致双绒毛膜同卵双胞胎(MZ双胞),这表明胚胎分裂可能发生在囊胚形成之后。
佳学基因为什么要研究同卵双胞胎的形成目标和理由对于单绒毛膜同卵双胞胎,生育过程基因解码根据辅助生殖技术(ART)病例和动物实验,对囊胚内细胞团(ICM)分裂所涉及的细胞机制进行了全面分析。此外,生育过程的基因解码批判性地重新审视了双绒毛膜同卵双胞胎的经典早期分裂模型。生育过程的基因解码探索了导致辅助生殖技术(ART)中两个胚泡分离的细胞机制,这可能导致双绒毛膜同卵双胞胎。
结果对于单绒毛膜同卵双胞胎(MZ双胞),ART 病例和小鼠实验证明,囊胚中较松散的囊胚内细胞团(ICM)会增加囊胚内细胞团(ICM)分离的可能性。囊胚腔形成或 8 字形孵化产生的物理力会施加在囊胚内细胞团(ICM)上,从而产生单绒毛膜同卵双胞胎(MZ双胞)。对于双绒毛膜同卵双胞胎(MZ双胞),经典模型类似于小鼠胚胎的体外人工克隆,需要严格控制分裂力、防止重新结合和适当聚集,从而允许在生理环境下形成两个独立的人类囊胚。相反,在非典型孵化或玻璃化冷冻循环后移植单个囊胚的辅助生殖技术(ART)程序可能会导致囊胚分离。不同动物模型系统的同卵双胞胎(MZ双胞)在形态、分子机制和时间方面的差异需要基因解码者给予更为复杂的思考,从而阻碍简单认识者的思考。正如在未来方向中所讨论的,人类胚胎创新体外模型的最新发展可能为人类胚胎发生过程中同卵双胞胎(MZ双胞)的细胞机制提供新的根本性见解提供有希望的途径。
研究同卵双胞胎的形成机制在生育上有更为广泛的意义双胞胎妊娠对胎儿和母亲都具有很高的风险。虽然单胚胎移植通常用于预防辅助生殖技术(ART)中的异卵双胞胎妊娠,但它无法防止同卵双胞胎(MZ双胞)的发生。根据生育过程的基因解码对单绒毛膜和双绒毛膜同卵双胞胎(MZ双胞)的细胞机制的理解,以及对遗传机制的洞察,可以在辅助生殖技术(ART)程序期间改进预测、预防甚至干预策略。

双胞胎的形成机制:囊胚内的内细胞团分裂,形成单绒毛膜同卵双胞胎;如果一个胚胎分裂成两个囊胚,就会形成双绒毛膜同卵双胞胎。
基于人体基因序列变化与人体疾病表征中的同卵双胞胎的介绍佳学基因注意到,在过去的四十年中,全球范围内双胞胎妊娠的发生率显著上升,这主要归因于辅助生殖技术(ART)的进步。双胞胎有两种类型:异卵双胞胎,由两个卵母细胞受精发育成两个不同的胚胎;同卵(MZ)双胞胎,即自然发生的由一个受精胚胎发育成的同卵个体。双胞胎妊娠对胎儿和母亲都具有很高的风险,包括双胞胎输血综合征、双胞胎逆向动脉灌注序列、早产、双胞胎消失以及各种妊娠并发症。在某些情况下,甚至会导致连体双胞胎的出生。虽然可以通过单胚胎移植降低异卵双胞胎的发生率,但预防同卵双胞胎仍然具有挑战性,因为同卵双胞胎的确切病因尚不完全清楚。
自一百多年来,人们一直在努力解开同卵双胞胎形成的谜团,最早可以追溯到上世纪初。最近,人们全面回顾了这段漫长的历史。然而,同卵双胞胎研究的主要限制是缺乏合适的哺乳动物模型,该模型需要满足较高的同卵双胞胎妊娠率。但是九带犰狳是一个例外,它仍然是唯一已知的能够自然产下同卵四胞胎的动物。尽管小鼠胚胎在体外经过人工干预后表现出与人类双胞胎发育的一些相似性,但小鼠中自然发生的同卵双胞胎(MZ双胞)很少见,而且很可能无法存活到出生,这可能是因为与正常胚胎相比,其细胞数量较少。围绕人类胚胎研究的伦理规定进一步限制了对同卵双胞胎(MZ双胞)的探索。直到最近,随着辅助生殖技术(ART)的快速进步和广泛使用,在植入前对人类胚胎进行体外实时观察才变得更加可行。同卵双胞胎的自然发生率约为 0.4%,但据报道,ART 病例中的同卵双胞胎发生率高于自然怀孕,范围从 0.72% 到 5%。因此,对辅助生殖技术(ART)期间 MZ 孪生的研究为探索其中涉及的未知机制提供了宝贵的线索。
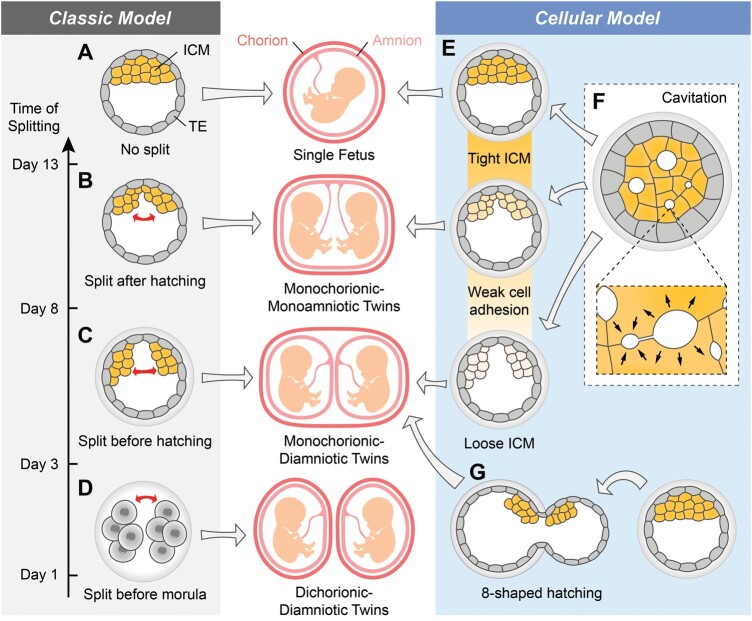
MZ 双胞胎是根据羊膜和绒毛膜的数量进行分类的,羊膜和绒毛膜是在怀孕期间包围和保护胎儿的膜。在人类中,绒毛膜主要由滋养外胚层 (TE) 发育而成,滋养外胚层构成了囊胚的外部细胞,而囊胚的多能性内细胞团 (ICM) 主要构成胎儿的所有组织(图 1A)。人们普遍认为,如果在囊胚阶段或之后,ICM 在被 TE 包围的一个囊胚腔内分裂成两组,就会形成共用一个绒毛膜的单绒毛膜同卵双胞胎(MZ双胞)(图 1B和C)。另一方面,双绒毛膜同卵双胞胎(MZ双胞)则是由囊胚内细胞团(ICM)和 TE 同时分离而产生的。传统上认为,这种分离是由于在桑葚胚阶段之前,即人类胚胎发育的最初 3 天内,卵裂球的分裂引起的(图 1D)。这导致两个独立的囊胚发育,形成同卵双胞胎(MZ双胞),每个都有各自的绒毛膜。然而,最近的辅助生殖技术(ART)病例与这种长期持有的观点不同,报告称单个囊胚移植可导致双绒毛膜同卵双胞胎(MZ双胞)妊娠,这表明在囊胚阶段之后发生了晚期分裂。
在这篇综述中,生育过程的基因解码将根据最近报道的辅助生殖技术(ART)研究以及小鼠胚胎研究,展示单绒毛膜和双绒毛膜同卵双胞胎(MZ双胞)形成的细胞机制证据,从而提出一种产生同卵双胞胎(MZ双胞)的新模型,这可能有助于减少辅助生殖技术(ART)期间同卵双胞胎(MZ双胞)妊娠的发生率,从而降低母亲和胎儿的健康风险。
单绒毛膜单卵双胞胎的细胞机制人们普遍认为,在囊胚阶段或植入后囊胚内细胞团(ICM)的分离会导致单绒毛膜同卵双胞胎(MZ双胞)的发育(图 1B 和 C)。有记录的人类囊胚在单个囊胚腔中包含两组独立的 ICM,甚至包含三个 ICM,分别导致单绒毛膜双胞胎或三胞胎妊娠。同样,在小鼠研究中,也在体外观察到具有双重囊胚内细胞团(ICM)的囊胚或甚至带有两个卵筒杯的植入胚胎。为了了解这些过程背后的细胞机制,需要解决的关键问题是:(i)ICM分裂的特征和(ii)导致分裂的物理力的性质。
内细胞团松散:分裂的原因经典的裂变模型导致人们推测细胞粘附缺陷可能是导致该现象的原因,并提出了细胞粘附分子 E-cadherin 在同卵双胞胎(MZ双胞)形成中的潜在作用。在辅助生殖中,当移植囊胚内细胞团(ICM)质量较差的囊胚(包括囊胚内细胞团(ICM)较松散的囊胚)时,MZ 双胞胎的出生率从 0.38% 增加到 1.38%。
这一理论得到了小鼠实验的支持,该实验最初并非为研究同卵双胞胎而设计,但却具有深远的意义。缺乏Jarid2(Jumonji,富含 AT 的交互式结构域 2,多梳阻遏物复合体 2 的组成部分)的小鼠胚胎干细胞 (mESC) 的 E-钙粘蛋白和其他控制细胞粘附的基因水平显著降低。有趣的是,当将Jarid2缺陷型 mESC 注射到小鼠胚胎的囊胚腔中时,在单个囊胚中观察到多个 ICM。此外,Jarid2的缺失会上调囊胚内细胞团(ICM)谱系标记Nanog并下调平面细胞极性信号基因Wnt9a、Prickle1和Fzd2。值得注意的是,注射过表达Nanog的 mESC或缺乏Wnt9a、Prickle1和Fzd2的 mESC也会导致约 35–48% 的囊胚中出现两个或更多 ICM。因此,细胞粘附性降低和囊胚内细胞团(ICM)松散很可能是导致囊胚内细胞团(ICM)分裂的重要因素,因此可能导致单绒毛膜 MZ 孪生(图 1E)。
分裂内细胞团的物理力量囊胚空化与移植早期卵裂期胚胎相比,延长胚胎培养和囊胚移植是辅助生殖技术(ART)手术中同卵双胞胎(MZ双胞)发生率较高的重要因素。在辅助生殖技术(ART)中,囊胚移植前囊胚腔形成过程中,间歇性塌陷和重新扩张的过程有可能导致人类胚胎囊胚内细胞团(ICM)分离。在单绒毛膜双胞胎的人类体外模型中进一步验证了ICM 分离可以在空化过程中发生。因此,囊胚空化过程的性质可能为理解囊胚内细胞团(ICM)分裂的潜在机制提供有价值的见解,从而有助于同卵双胞胎(MZ双胞)的发生。
虽然目前还没有关于人类胚胎的更深入的研究,但小鼠研究表明,小鼠植入前胚胎中囊胚腔的形成并非从某个单一点开始,而是从通过水力压裂在细胞与细胞连接之间形成的数百个微米大小的腔开始(图 1F)。这些充满水的小口袋逐渐释放其内容物,最终导致形成单一主导腔,即囊胚腔。当缺乏细胞粘附分子钙粘蛋白1(Cdh1)的母体突变胚胎与野生型胚胎结合形成嵌合体胚胎时,最终的囊胚腔与Cdh1敲除细胞一起收集。这表明,腔积聚的方向倾向于分离细胞与细胞接触较低的区域。
总而言之,如果处于囊胚形成阶段的植入前胚胎的内细胞连接松散,则它们更有可能通过多点空化和液体积聚而分离。这就像一种物理力量,将一个囊胚中的囊胚内细胞团(ICM)分成两个或三个不同的组,最终导致共用一个绒毛膜的同卵双胞胎(MZ双胞)的形成(图 1E 和 F)。
8 字形孵化在辅助生殖技术(ART)中,辅助孵化被广泛用于帮助胚胎脱离透明带 (ZP),从而促进其向着床发展。各种 ZP 操作技术都可辅助孵化,包括机械解剖、钻孔和减薄。虽然辅助孵化并不总是与同卵双胞胎(MZ双胞)有显著相关性,但其对辅助生殖技术(ART)过程中同卵双胞胎(MZ双胞)的潜在贡献有多种不同的意见和看法。
当通过机械辅助孵化或 ZP 钻孔在 ZP 上创建一个人工的小孵化缝时,囊胚将通过此开口孵化,呈现出类似数字“8”的形状(图 1G)。在 人工授精(IVF)案例中,8 形孵化人类囊胚的延时实时成像显示,位于孵化点附近的囊胚内细胞团(ICM)穿过囊胚中的这个孵化孔并分成多个部分(图 1G)。一部分囊胚内细胞团(ICM)留在 ZP 内,而另外两部分则在外面,因此会导致单绒毛膜三胞胎妊娠。在这种 8 形孵化事件中,一些靠近孵化点的囊胚内细胞团(ICM)细胞可能会发生细胞凋亡,ZP 上窄缝的压力将囊胚内细胞团(ICM)分成不同的细胞团群体。
小鼠实验也支持了这一现象,表明 8 字形孵化增加了囊胚阶段囊胚内细胞团(ICM)的分离。超过 20% 的小鼠胚胎在体外会出现这种 8 字形孵化。已证明孵化点和囊胚内细胞团(ICM)之间的相对位置对于 8 字形孵化过程中的囊胚内细胞团(ICM)分离至关重要,类似于人类胚胎。如果囊胚内细胞团(ICM)位于孵化点附近,则更有可能导致分离成两组或更多组 ICM(图 1G)。
然而,动物研究表明,体内孵化过程与体外孵化过程存在显著差异。在体内,在子宫中蛋白酶等溶解因子的帮助下,孵化迅速发生。ZP在体内经历整体溶解和完全溶解,不会膨胀和塌陷。然而,当通过辅助孵化在 ZP 中产生小的孵化点或间隙时,8 字形孵化更有可能在体外发生。
单绒毛膜单羊膜单卵双胞胎产生的基因因素在晚期人类囊胚中,ICM 分化为两种不同的细胞类型:内胚层,产生卵黄囊,外胚层发育成胚胎体和羊膜,羊膜是直接包裹人类胎儿的膜。在囊胚内细胞团(ICM)的外胚层未完全分成两部分但仍保持部分连接的情况下,单个绒毛膜内的双胞胎的羊膜也会合并,导致单绒毛膜单羊膜双胞胎(图 1B)。需要进一步研究以确定在囊胚空化过程中调节分离的囊胚内细胞团(ICM)簇之间间距的因素,从而影响羊膜的数量。
类似的现象也可以在斑马鱼同卵双胞胎(MZ双胞)突变体(称为janus)中观察到,其中胚泡的间距也决定了双胞胎表型的结果。在斑马鱼janus突变体中,胚泡在前四次卵裂期间分成两组,最终附着在胚黄的不同位置。如果分离的胚泡之间的距离太近,胚盘将在发育过程中部分融合,导致边缘区连体。虽然janus突变体可以模拟囊胚内细胞团(ICM)分离过程的某些方面,但表型不稳定,并且突变基因尚未确定。
然而,根据人类单绒毛膜单羊膜同卵双胞胎的经典分裂模型,人们认为它们起源于胚胎孵化后(甚至在着床后)ICM 的分裂,发生在胚胎第 8 天之后(图 1B)。尚不清楚单绒毛膜单羊膜同卵双胞胎是在囊胚空化过程中还是孵化后因部分ICM 分裂而产生。虽然这种类型的同卵双胞胎在双胞胎妊娠中并不常见,仅占活产同卵双胞胎的 1–2%,但如果两簇ICM 未完全分离,则有很大的风险导致连体双胞胎。由于它们发生率低且分裂较晚,很难通过活体成像观察它们的体外发育。此外,缺乏合适的动物模型,使得研究单绒毛膜单羊膜卵同卵双胞胎的机制变得十分困难。解决这一谜团可能对预防连体双胞胎的发生大有裨益,因为连体双胞胎会给后代带来极高的健康风险,并给家庭带来沉重的经济负担。
双绒毛膜同卵双胞胎的产生的基因因素在自然怀孕中,双绒毛膜双胞胎通常被认为是异卵双胞胎,即来自两个分别受精的卵母细胞,但这种假设并不一定正确。它们的合子性只能通过基因检测来确认,例如 DNA 指纹识别和短串联重复序列分析。因此,研究双绒毛膜同卵双胞胎(MZ双胞)的机制一直很有挑战性,直到有大量辅助生殖技术(ART)病例报告,其中单囊胚移植导致双绒毛膜双羊膜妊娠。最近,甚至有第一例报道的单囊胚移植后发生双绒毛膜双羊膜三胞胎妊娠。然而,这些双绒毛膜双胞胎即使在单胚胎移植后也可能是异卵双胞胎,其中一个双胞胎由ART移植胚胎发育而成,而另一个则通过排卵后自然受孕发育而成。为了排除这些双绒毛膜双胞胎是异卵双胞胎的可能性,一些研究通过基因检测来确认他们的单卵性。
然而,双绒毛膜双胞胎的主要争论点在于分裂过程的时间。最初,人们假设分裂发生在胚胎第 3 天之前的早期阶段,产生两个独立的囊胚,每个囊胚形成一个具有自己的绒毛膜和羊膜的同卵双胞胎(MZ双胞)(图 2A)。后来有人提出,分裂甚至可以在两细胞阶段第一次卵裂之后立即发生,发生在两个胚泡之间。然而,最近的辅助生殖技术(ART)案例表明双绒毛膜同卵双胞胎(MZ双胞)的分裂可能发生在囊胚期或更晚,这可能代表了与现有模型不同的一种替代机制。生育过程的基因解码将首先讨论桑葚胚期之前早期胚胎分裂的经典场景,然后基于辅助生殖技术(ART)案例和小鼠实验,探索单囊胚移植导致双绒毛膜同卵双胞胎(MZ双胞)背后的机制。

在人类胚胎致密化之前进行卵裂球活检,可使每组卵裂球发育成单个囊胚,类似于双绒毛膜同卵双胞胎的经典模型。然而,在无需人工干预的生理条件下,这一过程是否会发生仍存在争议。
通过卵裂球分离产生同卵双胞胎的实验最早是在绵羊和牛的胚胎中实现的。在小鼠胚胎中,最近的研究结果表明,早在二细胞阶段,细胞命运就已经在细胞之间出现分歧,其中一个卵裂球表现出比另一个更强的全能性。但在某些情况下,仍然可以通过在二细胞期平分胚泡来获得人工生成的双囊胚和个体(图 2B)。这些人工克隆过程可以为双绒毛膜同卵双胞胎早期分裂理论的可行性提供有价值的线索。
要通过卵裂球分离法在小鼠中成功生成同卵双胞胎(MZ双胞)胚胎,需要严格的条件。首先,需要通过在卵裂球上开一个缝隙或用 Tyrode 溶液完全去除卵裂球来将胚胎从卵裂球中释放出来。然后,使用移液器等物理力量或胰蛋白酶等化学剂将姐妹卵裂球分离。接下来,为了防止结合,需要在分离的空间中培养无卵裂球的半胚胎,以阻断它们之间的任何连接。此外,为了确保在没有 ZP 的情况下胚泡正确地三维聚集到囊胚中,应将一分为二的胚泡培养在受限环境中,例如 U 形或 V 形底孔(图 2B),甚至放回空的 ZP 中。
根据小鼠实验的证据,如何像经典理论所假设的那样,在无需人工干预的情况下,在生理条件下从早期分裂胚胎中分离出人类囊胚,有三个关键问题需要解决。
什么物理力量会导致桑葚胚阶段之前胚泡分裂?较薄的 ZP 或破裂的 ZP 与同卵双胞胎(MZ双胞)有关,在这种情况下,胚胎可以从 ZP 的限制中解放出来并进行分裂。最近,使用延时实时成像技术观察到了一例辅助生殖技术(ART)病例,其中人类胚胎自发早期分裂。早期分裂的人类胚胎的 ZP 在卵母细胞操作过程中破裂(图 2C)。精子显微注射和第一次卵裂后,两个胚泡中的一个从 ZP 中出现,而另一个留在里面。两个分离的胚泡分别发育成囊胚,有可能产生双绒毛膜同卵双胞胎(MZ双胞)(图 2C )。然而,要使这种情况在生理条件下发生,需要回答哪些力量或因素会导致体内ZP 破裂的问题。
胚胎早期分裂可能由多种机制引起。间期桥是一种微管细胞骨架致密结构,在植入前胚胎的间期连接姊妹胚泡,在细胞分裂过程中破裂可能导致细胞分离。此外,排斥和接触抑制可能发生在两个独立的胚泡之间,由 Eph/ephrin 信号等通路介导,这些通路调节细胞与细胞之间的接触和排斥,以保持细胞或组织边界。钙水平下降也被假设通过调节细胞粘附和诱导早期胚胎分裂来增加同卵双胞胎(MZ双胞)的发生率。
双胞胎胚胎如何在生理环境中防止自身重新结合?确保囊胚分离对于避免胚胎融合至关重要,因为人类胚胎可以在群体培养中融合。在某些情况下,异卵双胞胎的绒毛膜可以融合成一个。同样,小鼠囊胚也可以融合成一个具有两簇囊胚内细胞团(ICM)的嵌合囊胚。斑马鱼同卵双胞胎(MZ双胞)在孵化前通过附着在卵黄的不同部位来保持分离,这是哺乳动物胚胎所缺乏的独特特征。因此,为了在生理环境下支持双绒毛膜同卵双胞胎的早期分裂理论,需要进一步研究哪些因素或机制可以使双胞胎的胚泡分离直至着床。一种可能的情况是 ZP 破裂,其中一个双胞胎胚胎在 ZP 外部发育,另一个在 ZP 内部发育(图 2C)。这也可能归因于输卵管中纤毛驱动的液体流动,从而在两个不同的胚胎之间产生了空间间隙。
双胚泡如何确保正确聚集以避免在没有 ZP 的情况下胚泡分散?携带 ZP 基因(ZP1、ZP2或ZP3)突变的女性在自然受孕方面面临挑战,因为存在受精异常和植入前胚胎聚集不当的风险。ICSI 和体外培养等 ART可以帮助解决这些问题。在大多数情况下,为确保胚胎完整和成功怀孕,无 ZP 的人类胚胎在移植前在体外培养至囊胚阶段。无ZP胚胎移植的最早成功时间点是第3天,此时胚胎开始紧密结合,这可以提高成功妊娠率。为了提高无ZP人类胚胎的发育率,体外应用了Well-of-the-Well(WOW)系统,即在一个较大的孔内创建V形小孔以促进适当紧密结合。无ZP的人类胚胎也可以放回空的ZP或人工凝胶中以支持这些胚胎的发育。
但在生理条件下,如果胚胎在桑葚胚阶段之前分裂,无 ZP 的双胞胎胚胎由于细胞粘附性低而难以保持完整状态,并且可能难以正常紧密形成和囊胚形成。为了研究早期分裂的无 ZP 双胞胎胚胎是否能在体内实现正确聚集和成功发育,生育过程的基因解码需要模拟生理条件的模型系统。已经建立了几种实验装置来复制体外生理液体流动,可以模拟输卵管环境并研究早期无 ZP 胚胎的发育。
总体而言,要在生理条件下通过胚胎早期分裂产生双绒毛膜同卵双胞胎,胚胎必须满足几个严格的标准:它们需要物理力量在早期分裂并离开 ZP,同时在分裂后发育完整而不分散,还必须避免相互接触和融合。在生理条件下,通过早期分裂产生双绒毛膜同卵双胞胎的概率可能较低。需要进一步的研究和来自辅助生殖技术(ART)案例和动物实验的支持证据来了解双绒毛膜同卵双胞胎在生理条件下是如何发生的。
单囊胚移植后双绒毛膜同卵双胞胎的机制异常孵化导致辅助生殖技术(ART)中双绒毛膜同卵双胞胎的发生率更高在辅助生殖技术(ART)中,已报道了几例在单囊胚移植后因异常孵化而导致双绒毛膜同卵双胞胎(MZ双胞)妊娠的病例。在一些 8 字形孵化异常的病例中,ZP 上的缝隙很小,只有一半的囊胚内细胞团(ICM)可以从 ZP 中出来,而另一半则留在里面。当囊胚内细胞团(ICM)和 TE 都因激光钻孔的小缝隙产生的压力而分成两半时,可能会导致形成两个分离的囊胚,从而形成同卵双胞胎(MZ双胞),每个双胞胎都有自己的绒毛膜(图 2D)。这一概念与畜牧业中用于绵羊、牛、山羊和猪等哺乳动物的人工克隆方法相似,其中用尖针将囊胚直接分成两半(图 2E)。
玻璃化加热循环可导致双绒毛膜同卵双胞胎迄今为止,仅有一例报道,其中观察到玻璃化冷冻加温周期中的胚胎分离成两个囊胚,从而导致双绒毛膜同卵双胞胎(MZ双胞)的诞生(图 2F)。在胚胎冷冻和复温后囊胚腔重新扩张的过程中,一些细胞可能保持完整,巧合的是,ICM 和 TE 分离成在 ZP 内形成的两个小的分离囊胚(图 2F)。虽然这是唯一一例具有明确囊胚分离表型的报道,但也有原因不明的病例,即在移植单个玻璃化冷冻加温囊胚后发生双绒毛膜同卵双胞胎(MZ双胞)妊娠,这些病例可能具有相同的潜在机制。
目前认识的不足及基因解码的未来方向同卵双胞胎的现有模型及其局限性虽然人类并不是唯一出现同卵双胞胎的物种,但目前还没有完美的动物模型来研究人类同卵双胞胎的机制,这阻碍了该领域的研究。在本文中,生育过程的基因解码将总结目前已知的同卵双胞胎物种,并解释它们在研究人类同卵双胞胎方面的局限性。此外,生育过程的基因解码将提出体外人类胚胎模型,这些模型有望在未来的研究中研究人类同卵双胞胎。
斑马鱼斑马鱼是一种广泛使用的脊椎动物模式生物,具有体外受精和生长的显著优势,可以全面观察整个发育过程。然而,与哺乳动物胚胎相比,它的胚胎结构和发育模式存在显著差异(图 3A上图),这给其在人类双胞胎研究中的应用带来了挑战。一种被称为janus 的斑马鱼同卵双胞胎(MZ双胞)突变体显示出两个不同的胚泡簇,它们紧密附着在一个卵黄上(图 3A下图)。然而,控制胚泡分裂的机制尚不完全清楚,导致这种自然突变的基因也有了一定的信息。主要的挑战是表型的不稳定性,它对温度敏感并通过母体隐性模式遗传。总体而言,斑马鱼胚胎的结构差异和突变体的复杂遗传模式使其成为研究人类同卵双胞胎(MZ双胞)的理想动物模型。
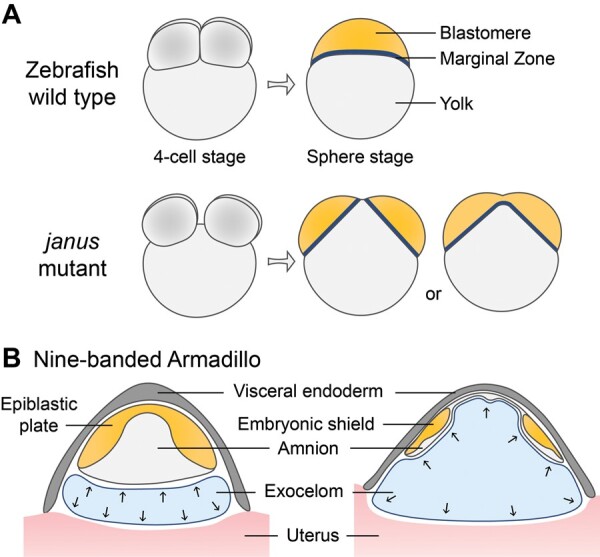
九带犰狳是已知的唯一能自然且持续地产下同卵四胞胎的动物 。然而,合子分裂的时间发生在植入之后,这与人类的双胞胎有显著不同 。在九带犰狳中,胚胎不会在囊胚形成后立即植入。相反,它会经历一个长达数月的延迟。囊胚植入后,ICM 会形成单个羊膜和外胚层板。在 TE 植入部位和羊膜之间,形成了一个名为外胚层的独特腔体 (图 3B )。随后,外胚层板分化为分离的胚盾,每个胚盾都能够发育成一个个体。随着外腹腔显著扩张,它会产生一种物理力,最终将四个胚胎盾分裂到不同的位置,产生相同的四胞胎(图 3B)。这种机制是该物种所独有的,并不能为人类同卵双胞胎提供重要的见解。此外,九带犰狳通常不被用作研究实验室使用的模型生物,因此不易用于胚胎研究。
老鼠尽管小鼠是当前科学研究中最常用的哺乳动物模型,但根本的差异限制了它们与人类胚胎在同卵双胞胎研究中的相似性。在生理条件下,小鼠同卵双胞胎的自然发生率极其罕见。一个重要的问题是,小鼠不是单胎动物,因此很难在不进行基因检测的情况下确定哪两个胚胎源自一个卵母细胞。此外,小鼠同卵双胞胎胚胎可能面临劣势,因为与完全源自单个受精卵母细胞的邻近胚胎相比,其细胞数量较少,这可能导致它们在自然竞争中丢失。因此,在小鼠中获得同卵双胞胎的可能性较小。此外,小鼠胚胎的发育在各个方面与人类胚胎有显著不同,例如合子基因组激活的时间、压缩、着床、原肠胚形成等等。尤其是,人类胚胎从附着在囊胚内细胞团(ICM)上的极性 TE 植入,而小鼠胚胎则从与囊胚内细胞团(ICM)相对的壁间 TE 植入。由于这些差异,MZ 双胞胎的发育无法用小鼠胚胎完全复制或准确模仿,因为小鼠胚胎具有其独有的特征。这仅在从人类辅助生殖技术(ART)案例中获得了见解并且在特定植入前阶段的小鼠胚胎中评估和验证了潜在机制的情况下才有用,例如非典型的 8 字形孵化和囊胚内细胞团(ICM)分离。因此,在同卵双胞胎(MZ双胞)出生率较高的辅助生殖技术(ART)流程中研究人类胚胎中的同卵双胞胎(MZ双胞)仍然是解决生育基因解码中提出的基本问题的最直接和有效的方法。
人类胚胎发生的体外模型在辅助生殖技术(ART)治疗中,人类胚胎只能在体外培养至囊胚阶段后才能植入子宫,这是观察囊胚阶段后人类胚胎研究的主要限制因素。出于伦理考虑,将人类胚胎长期体外培养用于科学研究受到严格限制。因此,生育过程的基因解码缺乏有关囊胚内细胞团(ICM)是否可以在孵化后甚至植入后分裂以产生单绒毛膜同卵双胞胎(MZ双胞)的资料。此外,还有许多无法解释的辅助生殖技术(ART)病例,其中单个囊胚移植导致了同卵双胞胎(MZ双胞)甚至 MZ 三胞胎。最近,利用诱导性多能干细胞 (iPSC) 或分离的人类胚胎干细胞创建体外系统来模拟早期人类胚胎发生方面取得了进展,并取得了令人鼓舞的结果,形成了称为胚泡的囊胚状结构,甚至是植入后的人类胚泡。这些模型可能提供前所未有的机会来研究囊胚内细胞团(ICM)和 TE 在孵化后甚至植入后是否仍能分离。
事实上,在一些双胞胎胚泡中观察到了单个胚腔内的双重 ICM,这是一种通过增加细胞数量并用溶血磷脂酸处理双胞胎胚泡来研究人类同卵双胞胎(MZ双胞)的有价值的模型。在腔扩张期间,ICM 分离,每个囊胚内细胞团(ICM)都包含外胚层和内胚层细胞,模仿单绒毛膜同卵双胞胎(MZ双胞)的表型。该体外模型系统可用于进一步研究囊胚内细胞团(ICM)分离的潜在机制、ICM 间距的控制以及同卵双胞胎(MZ双胞)的植入后发育。
寻找“双胞胎基因”目前,生育过程的基因解码对同卵双胞胎机制的理解主要集中在细胞层面,而推动这一过程的遗传机制仍需进一步研究和发现。生育基因解码认为,ART 中同卵双胞胎率的升高并非归因于技术本身,而是胚胎的遗传背景。
科学家认为同卵双胞胎受基因调控,原因有二。首先,与异卵双胞胎不同,同卵双胞胎在人群中的发生率在不同地区相对一致,大约为每 250 次怀孕中就有 1 次。其次,有报道显示同卵双胞胎的家族性案例长达四代。科学家进行了大量研究,试图揭示同卵双胞胎形成的遗传机制。同卵双胞胎是一种常染色体显性遗传,与细胞粘附相关的基因一直是造成同卵双胞胎的嫌疑基因之一。通过对一个四代同卵双胞胎家系的全基因组测序,发现上皮黏附连接信号通路、GTPase 家族介导的通路和紧密连接信号通路中单核苷酸变异和拷贝数变异的富集。突变的基因可能会降低囊胚内细胞团(ICM)的粘附性,导致囊胚腔空化过程中囊胚内细胞团(ICM)分裂。尽管付出了巨大的努力,但直接导致人类同卵双胞胎的特定基因尚未被确定。同卵双胞胎背后的遗传机制很难揭示,因为它可能不仅仅单个基因的突变有关,而且即使单个基因存在突变,其影响也可能不是完全渗透的。
除了遗传机制外,最近还发现了同卵双胞胎的表观遗传特征。同卵双胞胎和异卵双胞胎之间的差异甲基化位置始终存在于其体细胞中,这为识别同卵双胞胎提供了一种新方法。与细胞粘附途径相关的基因在最接近差异甲基化位置的基因中表现出显著富集。
“双胞胎基因”的发现可能让生育过程的基因解码进一步了解同卵双胞胎在遗传和表观遗传层面的细胞机制,以及与地域起源或谱系相关的双胞胎率。
对降低辅助生殖技术(ART)治疗中同卵双胞胎率的影响随着辅助生殖技术(ART)的进展和成功率的提高,单胚胎移植的做法已变得普遍,以减少多胎妊娠的发生。然而,单胚胎移植后仍有可能出现同卵双胞胎。根据生育过程的基因解码通过报道的辅助生殖技术(ART)病例和动物研究分析的细胞机制,应考虑采取以下措施,以尽量减少 人工授精(IVF)过程中同卵双胞胎的发生。在移植前,必须使用高分辨率延时实时成像等尖端技术全面监测辅助生殖技术(ART)胚胎的发育情况,确认囊胚的表型。为了减少单绒毛膜同卵双胞胎(MZ双胞)的发生,应避免使用囊胚内细胞团(ICM)连接松散或分成多组的囊胚。为了降低双绒毛膜 MZ 双胎妊娠的发生率,不应将呈现非典型 8 字形孵化或分裂囊胚的胚胎作为移植的首选。进行辅助孵化时,重要的是在距离囊胚内细胞团(ICM)较远的地方创建人工孵化位,以防止囊胚内细胞团(ICM)在 8 字形孵化过程中分裂。此外,采用更类似于 ZP 自然降解而非制造单个小孔的技术可能会有所帮助。实施这些措施可以在一定程度上帮助减少辅助生殖技术(ART)中同卵双胞胎(MZ双胞)的发生。
双胞胎发生的基因机制的学科共识总之,生育过程的基因解码对单绒毛膜同卵双胞胎细胞机制的了解正在不断加深,涉及多点囊胚腔扩张过程中松散的囊胚内细胞团(ICM)分裂,导致囊胚内形成单独的囊胚内细胞团(ICM)簇。另一方面,双绒毛膜同卵双胞胎的自然发生仍知之甚少,且极具争议。在辅助生殖技术(ART)中,非典型 8 字形孵化和玻璃化-加温周期与囊胚分离和双绒毛膜同卵双胞胎的形成有关。然而,在自然生理条件下发生的机制似乎截然不同且不清楚。为了获得进一步的见解,同卵双胞胎模型需要不断检查和潜在的修改,特别是随着未来辅助生殖技术(ART)流程、动物实验和使用 iPSC 衍生的胚泡、原肠胚和其他胚胎类器官的人类模型中报告病例的积累。随着同卵双胞胎模型的更新,ART 中的胚胎移植策略也应进行调整,以降低同卵双胞胎的发生率。此外,探索其中涉及的遗传和表观遗传机制将使生育过程的基因解码更接近解开同卵双胞胎(MZ双胞)的秘密。