编者按:近年来糖尿病治疗药物研发突飞猛进,GLP-1RA类药物成为其中的佼佼者,但多肽类药从注射剂型转为口服剂型一直是药物研发上的难题。借助“SNAC吸收促进剂”创新技术,司美格鲁肽片成功突破了技术壁垒,实现了GLP-1RA类药物经口服途径给药的历史性跨越,成为第一个真正意义上的口服多肽类药物。在中华医学会第二十一次内分泌学学术会议(CSE2024)上,针对口服GLP-1RA类药物研发及进展进行了专题学术报告,本文将撷取报告精华,与读者共享。
百年坚守:研发创新是人类社会发展的重要引擎
研发创新是人类社会发展的重要引擎。从“蒸汽机”到“人工智能”,研发创新不断改善生活,也是人类攻克疾病的有力武器。多年来,科学家们一直深耕糖尿病领域。1921年,Banting博士和医学院学生Best首次成功分离出了胰岛素[1],胰岛素的糖尿病治疗之旅正式开启。从动物胰岛素到人胰岛素的升级,再到人胰岛素向胰岛素类似物的跨越,不断满足不同患者的治疗需求。在开发和利用胰岛素的过程中,人们逐渐发现GLP-1在血糖和能量代谢过程中起着重要的作用,开始致力于研发以GLP-1为靶点的药物。纵观整个GLP-1RA类药物的研发历史,从最开始动物源性GLP-1RA,到副作用更小的人源性GLP-1RA,再到可以更方便给药的GLP-1RA周制剂和口服制剂,创新变革的步伐从未停止。
创新突破:口服GLP-1迎来曙光
渗透促进剂SNAC助力突破胃肠道屏障
口服多肽一直是研究热点,口服多肽想要顺利抵达系统循环,需在避免降解的条件下通过肠上皮细胞,然后分泌到淋巴系统或血液中,需要绕过多种结构和功能障碍。药物的渗透性、稳定性,以及个体差异性都是必须考虑的问题(图1),多肽药物的口服吸收面临重重困难。为了解决这一难题,研究者们采取了多种策略,包括多肽的化学修饰、添加佐剂、药物载体、载药装置[2]。其中,渗透促进剂是改善口服肽吸收的最广泛测试方法。

图1. 多肽药物的口服吸收面临重重困难
SNAC,即N-[8-(2-羟基苯甲酰)氨基]辛酸钠,是一种化学合成的脂肪酸衍生物,为Emisphere公司技术平台的核心载体,作为渗透促进剂广泛应用于多种药物的临床开发[3]。目前已有含SNAC的口服制剂获FDA批准,包括维生素B12和司美格鲁肽片,同时SNAC获得FDA的GRAS认证[3]。SNAC的促吸收作用已经得到多项研究证实。2011年发表的一项Ⅱ期临床试验结果显示,基于SNAC技术的口服维生素B12显著提高口服生物利用度[4]。另一项研究显示,基于SNAC技术的口服肝素具有潜在抗血栓活性[5-6]。
SNAC携手司美格鲁肽实现口服化的机制探索
研究显示,80mM SNAC使司美格鲁肽的表观渗透性显著增加约7倍,SNAC促进司美格鲁肽在胃内而非肠道吸收,而无法促进利拉鲁肽的体内吸收[7]。为探索司美格鲁肽片吸收的解剖部位,26例受试者在禁食状态下单次口服司美格鲁肽片,全部受试者均观察到片剂在胃中完全崩解[7-8]。当片剂在胃内崩解后,SNAC通过升高人工胃液中pH值,趋近于中性水平,从而保护司美格鲁肽片不易被胃蛋白酶降解[7]。胃蛋白酶是胃中的一种主要消化酶,在酸性环境下,其活性得到增强,司美格鲁肽快速降解;而随着pH升高,司美格鲁肽降解速度减缓,半衰期延长[7](图2)。
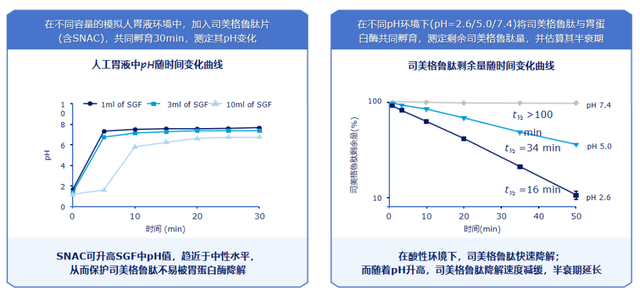
图2. SNAC可升高局部pH值,抵抗胃蛋白酶降解
另一方面,SNAC有助于维持司美格鲁肽的单体状态,增强渗透性。脂肪酸酰化的GLP-1类似物具有低聚化倾向,影响其吸收。研究结果显示,在司美格鲁肽浓度一致的情况下,添加SNAC后司美格鲁肽沉降系数分布曲线左移,提示司美格鲁肽由低聚物向单体状态转化[7]。SNAC的促渗透作用与共同配制的GLP-1RA结构相关。司美格鲁肽倾向于形成二聚体,SNAC可促进其向单体状态转变,促进其跨膜吸收[7]。
此外,司美格鲁肽连接了C-18脂肪二酸侧链,脂肪二酸部分平衡了侧链的膜结合特性,有助于跨细胞转运吸收[7,9]。SNAC通过跨细胞转运形式促进司美格鲁肽吸收(图3)[7]。由于具有亲脂性,SNAC可以有效地插入胃上皮细胞膜,增加膜流动性,有利于药物的跨细胞转运[7,10]。SNAC也可进入胃粘膜细胞的脂质膜层,使其脂质膜发生扰动,进而可逆性地促进司美格鲁肽的跨膜吸收[7]。胃内司美格鲁肽片主要在片剂周围吸收,而且早期即能够被全身快速吸收[7]。

图3. SNAC通过跨细胞转运形式促进司美格鲁肽吸收
综上所述,SNAC助力司美格鲁肽实现口服给药的作用机制:司美格鲁肽片的吸收主要在胃内进行;SNAC可增加局部pH,抑制胃蛋白酶降解作用;SNAC有助于维持司美格鲁肽的单体状态,增强渗透性;SNAC通过增加膜流动性来增加跨细胞吸收。
司美格鲁肽片药代动力学概览
SNAC辅助下司美格鲁肽的体内药代动力学(PK)特征
吸收:给药1h后达到最大浓度,4~5周后达稳态浓度,根据群体PK估算,司美格鲁肽暴露量与剂量成正比,绝对生物利用度达0.4%~1.0%;
分布:估计分布容积约8L,可与血浆白蛋白广泛结合(>99%);
代谢:肽骨架经蛋白水解裂解,脂肪酸侧链经连续β-氧化代谢;
排泄:半衰期约1周,清除率约0.04L/h;主要排泄途径是经尿液和粪便排泄;仅约3%的司美格鲁肽以原型经尿液排泄[11](图4)。
SNAC的体内药代动力学特征
吸收:给药后SNAC被迅速吸收和消除,单次和多次给药后SNAC的PK特征相似,多次给药后SNAC无蓄积;
代谢:SNAC作为脂肪酸衍生物,通过氧化及葡萄糖醛酸化进行代谢;
排泄:多种不同的终末代谢产物主要经尿液排出,少量经粪便排出[11](图4)。

图4. 药代动力学特征
安全性方面,肝功能受损不影响司美格鲁肽片的暴露量,不造成SNAC蓄积,FDA/EMA/中国说明书指出:不同程度肝功能受损患者无需调整剂量[12-15];肾功能受损不增加司美格鲁肽片的暴露量,不造成SNAC蓄积,FDA/EMA/中国说明书同样指出:轻中重度肾功能受损患者无需调整剂量[13-16];上消化道疾病对司美格鲁肽片的血浆暴露无明显影响[17];SNAC对常用药物的PK特征无临床意义的影响[18-20];司美格鲁肽片与常用药物联用并未增加新的安全性风险[18-20]。
总结
作为全球首个口服GLP-1RA,司美格鲁肽片易被患者接受,从而提高患者用药依从性,司美格鲁肽片还具有强效降糖及多重代谢获益,为糖尿病患者提供了新的选择。与此同时,进一步推动了GLP-1RA在T2DM人群的广泛应用,有助于糖尿病患者早期血糖优质达标,惠及更多的中国患者。
参考文献
1.Fralick M, et al. Diabetologia. 2021 May;64(5):947-953.
2.Zhu Q, et al. Acta Pharm Sin B. 2021 Aug;11(8):2416-2448.
3.Twarog C, et al. Pharmaceutics. 2019 Feb 13;11(2):78.
4.Castelli M C , et al. Clinical Therapeutics, 2011, 33(7):934-945.
5.Arbit E , et al. Thrombosis Journal, 2006, 4(1):6.
6.Pineo G, et al. Best Pract Res Clin Haematol, 2004, 17(1): 153-60.
7.Buckley ST, et al. Sci Transl Med. 2018 Nov 14;10(467):eaar7047.
8.Baekdal TA, et al. Clin Pharmacol Drug Dev. 2021 May;10(5):453-462.
9.Venanzi M , et al. Soft Matter. 2020 Nov 18;16(44):10122-10131.
10.宁美英, 等. 国际药学研究杂志, 2005, 32(1):56-61.
11.FDA, RYBELSUS ?. CLINICAL PHARMACOLOGY REVIEW(S).
12.Baekdal TA, et al. J Clin Pharmacol. 2018;58:1314-1323.
13.Rybelsus . FDA Product information.
14.Rybelsus. EPAR Product information.
15.司美格鲁肽片,中国说明书
16.Granhall C, et al. Clin Pharmacokinet. 2018;57:1571-1580.
17.Meier J J , et al. Diabetes Obes Meta. 2022 Apr;24(4):684-692.
18.B?kdal TA, et al. Clin Pharmacokinet. 2019 Sep;58(9):1193-1203.
19.Jordy AB, et al. Clin Pharmacokinet. 2021 Sep;60(9):1171-1185.
20.Hauge C, et al. Expert Opin Drug Metab Toxicol. 2021 Sep;17(9): 1139-1148




吹