尽管进行了大量的研究工作,但SAPHO综合征的发病机制仍不完全清楚。目前的证据表明SAPHO是免疫失调、遗传易感性和环境因素之间复杂相互作用的结果。虽然一些研究中某些家庭成员患有这种疾病表明存在遗传倾向,但没有明确的特定基因与这种疾病相关。一些研究提出与人类白细胞抗原(HLA)(例如 HLA-A26、HLA-B27、HLA-B39 和 HLA-B61)存在潜在关联,但这些基因与SAPHO(尤其是 HLA-B27)之间的关系尚未明确。
此外,一些核苷酸多态性(MDM2 T309G、p53 G72C、rs6908425 和 CDKAL1 T > C)被认为与SAPHO相关,但仍然缺乏支持这一假设的令人信服的证据。虽然疾病涉及1号和18号染色体上的某些基因(LPIN2、PSTPIP2 和 NOD2)被认为与SAPHO综合征具有共同的临床特征,但尚未在患有该疾病的个体中观察到这些关联。
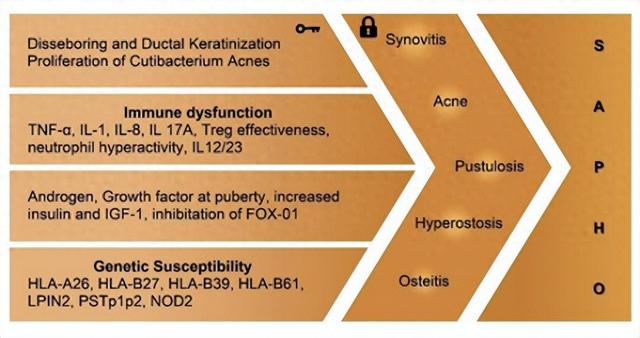
在SAPHO综合征的发展过程中,感染被认为是最重要的环境因素之一。从 SAPHO患者的骨和关节病变中采集的组织样本显示存在多种微生物,包括痤疮皮肤杆菌(C.痤疮)(以前称为丙酸杆菌)、金黄色葡萄球菌、副流感嗜血杆菌、梅毒螺旋体和放线菌,表明它们在发育中的潜在作用。在这些微生物中,痤疮丙酸杆菌(一种革兰氏阳性、厌氧、生长缓慢的细菌)被认为是最重要的。痤疮丙酸杆菌主要共生于皮脂腺中,少量共生于肠道中。根据一项研究,SAPHO综合征患者的骨活检中42%被发现含有这种微生物。
然而,由于微生物生长缓慢,并且需要先进的实验室技术(例如 PCR)和检测专业知识,因此检测SAPHO患者中痤疮丙酸杆菌的存在可能具有挑战性,这可能会增加这一比率。某些研究调查了痤疮丙酸杆菌如何导致SAPHO综合征。这些研究提出,由于损害其消除的遗传或分子缺陷,微生物可以不受控制地生长,并随后产生各种可以直接或间接损害宿主细胞的酶和代谢物。
据推测,这种情况可能与SAPHO患者中负责消除痤疮丙酸杆菌的自然杀伤 (NK) 细胞水平低于健康对照有关,以及负责清除细菌的Forkhead Box O1 (FoxO1) 蛋白受到抑制通过西式饮食和雄激素等多种机制,以及痤疮丙酸杆菌激活补体,导致促炎细胞因子的释放,例如如白细胞介素 (IL)-1、IL-8、IL17-A 和肿瘤坏死因子 (TNF)-α。这些细胞因子可以影响细胞和体液促炎途径。此外,一项实验研究表明,将痤疮丙酸杆菌注射到大鼠关节区域会导致关节区域糜烂以及滑膜细胞增殖,凸显了这种微生物对关节健康的显着影响。

SAPHO综合征是自身免疫性疾病还是自身炎症性疾病的分类仍不确定。然而,目前的证据表明,SAPHO更可能是一种自身炎症,这是由多种因素造成的,包括中性粒细胞过度活跃、自然杀伤 (NK) 细胞减少、白细胞介素 (IL)-1 水平升高和a 抗IL-1治疗呈阳性反应。此外,SAPHO 综合征与多种自身炎症综合征有相似之处,包括 Majeed、DIRA(IL-1 受体拮抗剂缺乏)、PAPA(化脓性关节炎、坏疽性脓皮病、痤疮)和 PASS(坏疽性脓皮病、寻常痤疮、化脓性汗腺炎)蒂瓦和强直性脊柱炎)。
这些疾病与SAPHO表现出不同程度的相似性,并且对抗 IL-1 治疗反应良好。此外,动物模型也支持SAPHO综合征的自身炎症起源,缺乏PSTPIP2的小鼠表现出与SAPHO相似的临床症状,如滑膜炎、骨质增生、骨炎和多灶性骨髓炎;巨噬细胞和中性粒细胞在骨骼、关节和皮肤中积聚;以及血液中 IL-1 水平升高。值得注意的是,这些小鼠的肠道内还表现出普雷沃氏菌的过度生长,这与 IL-1β 的产生增加有关,类似于 SAPHO 和痤疮丙酸杆菌之间的关系。因此,SAPHO综合征很可能属于自身炎症性疾病组。
SAPHO综合征患者细胞因子水平异常(例如 IL-1、IL-8、IL-17、IL-18 和 TNFα)表明Th-17通路参与其中。SAPHO中出现的炎症的拟议机制涉及由 NK 细胞减少引起的Th-17和调节性 T 细胞 (T-reg) 之间的不平衡。由于无法消除痤疮丙酸杆菌,这会刺激先天免疫系统,最终通过各种机制(包括 T 细胞介导的免疫过程)导致SAPHO综合征的慢性炎症。
大环内酯类抗生素,如阿奇霉素,已被证明可有效治疗SAPHO综合征,特别是改善皮肤表现,并在一定程度上改善骨关节 (OA) 症状。尽管如此,在大多数情况下,停药后复发很常见,这表明虽然感染过程促进了疾病的发展,但其他机制也参与了其持续存在。
