牛皮癣的发病机制涉及先天性和适应性免疫反应,在不同的临床阶段过度活跃,并以特定的炎症模式为特征。先天性免疫过程在早期/急性阶段占主导地位,而诸如pDC,嗜中性粒细胞,肥大细胞和巨噬细胞等免疫细胞在皮肤病变中丰富,而适应性免疫反应是慢性牛皮癣的典型特征。IFN-α和其他先天性免疫介质(例如抗微生物肽)的局部过量生产,也是早期牛皮癣的特征。相反,在慢性病发展过程中,不再产生I型干扰素,部分是由于TNF-α的抑制作用,这决定了先天免疫过程的下降和适应性免疫反应的增强。在此阶段,TNF-α对于mDC的免疫激活很重要,在遇到致病性抗原后,mDC负责T细胞的扩增。
在这项研究中,我们发现抗TNF-α治疗引起的HS感染患者引起了自相矛盾的牛皮癣,与早期牛皮癣非常相似。


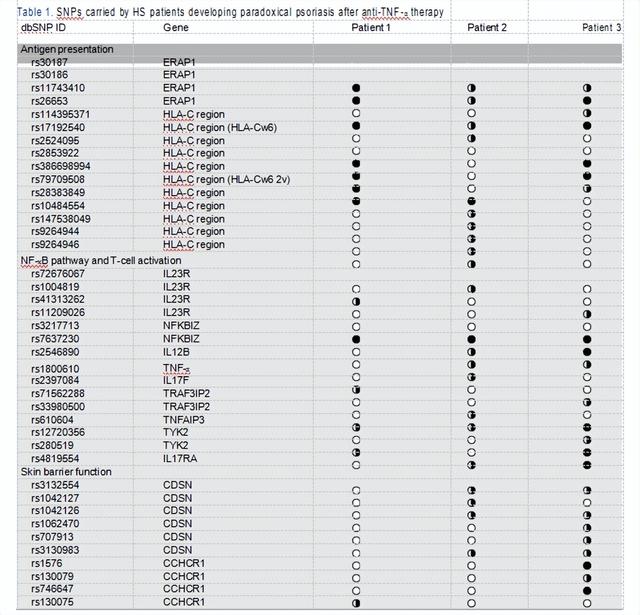
实际上,通过比较自相矛盾的牛皮癣和经典牛皮癣的皮肤病变,我们观察到明显的皮肤如“材料和方法”部分所述,从HS患者1-3的血液样本中获取DNA,并在MiSeq系统中通过下一代测序技术分析SNP。对于每个样品,开发了一个44个扩增子的cDNA文库,这些扩增子可能包含71个位于牛皮癣易感基因中的SNP。携带SNP的基因根据其功能进行分类(即控制抗原呈递,NF-κB途径和T细胞活化,皮肤屏障)。
先天免疫细胞(包括pDC,嗜中性粒细胞,肥大细胞和巨噬细胞)的积累。同时,在矛盾的反应中,潜在地诱导银屑病表型的先天免疫分子的表达水平大大增加。其中,抗TNF-α治疗后,HS患者皮肤中IFN-α2a,IFN-β和IFN-λ1过表达。还有LT-α和LT-β与经典牛皮癣相比,在悖论性牛皮癣中检出的胆固醇和LL-37含量很高。在经典牛皮癣,疾病发展的早期以及悖论性牛皮癣中已经描述了短暂的IFN-α上调。同时,已知IFN-β在两种情况下均由pDC表达。我们发现IFN-β以及IFN-κ和淋巴毒素在矛盾的皮肤反应的表皮区室,以及渗透到真皮中的pDC和白细胞中令人印象深刻地表达了它们。角质形成细胞释放的I型IFN和淋巴毒素可能在悖论性牛皮癣中具有基本的致病作用。
然而,这些分子促进银屑病皮肤表型的机制尚不清楚,无论是在矛盾的还是在经典的牛皮癣中。相反,已经广泛研究了IFN-α的免疫功能,特别是在经典牛皮癣中,已知诱导Th17反应[40]。在自相矛盾的牛皮癣中,IFN-α可能具有不同的作用,而没有抗原特异性的Th17反应。它可以诱导表皮水平的趋化因子,例如CXCL10和CXCL9,它们负责募集DC和非特异性T细胞。这些炎性细胞反过来可以在悖论反应中维持和放大局部炎性反应。
如前所述,在自相矛盾的牛皮癣中,先天免疫参与者的诱导取决于TNF-α功能的丧失,从而限制了皮肤中的先天免疫反应。实际上,TNF-α的阻断决定了pDC的积累和对它们成熟的抑制。结果,pDC可以释放非常高水平的I型IFN-α6和IFN-β,从而导致矛盾的牛皮癣。与pDC一起,我们发现了HS患者牛皮癣样病变中存在其他先天免疫细胞。其中,CD15 [+]中性粒细胞,c-kit / CD117 [+]肥大细胞,CD68 [+]巨噬细胞和单核细胞大量浸润真皮,产生矛盾的皮肤反应。如前所述,这种白细胞亚群的模式与早期银屑病非常相似,并且与IL-36细胞因子的局部高产生以及银屑病初始阶段过度活跃的先天免疫过程一致。
相反,与矛盾型牛皮癣相似,受自身免疫性疾病(包括牛皮癣和克罗恩氏病)影响的患者的不良HS可能取决于TNF-α阻断引起的异常先天免疫反应。实际上,在牛皮癣皮肤中发现了许多牛皮癣常见的致病细胞因子,包括IL-36,以及活跃于嗜中性粒细胞和受影响区域中大量存在的Th17细胞的炎性介质。除pDC以外,还可以通过角质形成细胞,成纤维细胞和内皮细胞(即CCL20,chemerin)释放的趋化因子来招募先天免疫细胞,其表达取决于驻留皮肤细胞自身产生的I型干扰素。实际上,除了控制pDC中I型IFN的表达外,TNF-α可能会对细胞产生负调控。
众所周知,这些分子还存在于角质形成细胞中,也有助于诱导早期牛皮癣的先天免疫途径。我们的发现支持了这一假设,即I型干扰素在矛盾型牛皮癣的角质形成细胞中被诱导,反之亦然,在慢性斑块状牛皮癣中含量较低。如体外培养的pDC所证实的,重要的是要在体外TNF-α阻断后在原代角质形成细胞培养物中确认先天免疫介质的高表达。与悖论性牛皮癣类似,分析急性牛皮癣是否在表皮区室中显示I型IFN和淋巴毒素的过度表达也很重要。在那种情况下,可以认为TNF-α暂时限制了不仅由pDC引起的先天免疫过程,而且还限制了由角质形成细胞引起的先天免疫过程,以释放牛皮癣皮肤中的适应性免疫应答。
关于淋巴毒素在反常反应和经典牛皮癣中的未知表达和作用,以前的研究证实了LT-α和TNF-α在确定IκBα[-]中NF-κB介导的皮肤炎症反应中的关键作用。此外,接受依那西普治疗的银屑病关节炎患者血清LT-α水平升高。因此,淋巴毒素可能与牛皮癣的发病机制密切相关,TNF-α可以严格控制其在角质形成细胞和淋巴细胞中的表达。需要进一步的研究来评估LT-α和LT-β的表达及其在牛皮癣发展不同阶段的作用,并了解角质形成细胞衍生的淋巴毒素的功能。
对悖论性皮肤反应中T细胞浸润的分析表明,与慢性牛皮癣相比,悖论性牛皮癣中产生IFN-γ-或TNF-α的CD3 [+]细胞显着减少。但是,CD8 [+]和IL-17 [+]淋巴细胞在牛皮癣样反常反应中存在,其水平与牛皮癣相当,即使可以想象它们是非特异性募集的。如果我们认为这是典型的牛皮癣慢性期的典型表现,则在矛盾的皮肤反应中不出现I型IFN T细胞反应的破裂并不令人感到惊讶。相反,即使阳性细胞大多表现出巨噬细胞样形态,HS病人的牛皮癣反应中产生IL-22的细胞也会增加。我们的发现扩展了以前的研究,这些研究显示了自相矛盾的牛皮癣中IL-22 mRNA表达的上调,并鉴定了先天免疫细胞,而不仅仅是T淋巴细胞是IL-22的细胞来源。IL-22过表达可能是悖论性银屑病皮损表皮典型角质形成细胞过度增殖和去分化的原因。
最后,尽管在矛盾的牛皮癣中可以有效地建立由驻留皮肤细胞诱导局部趋化因子和细胞因子产生的炎性细胞因子环境,但似乎不足以诱导HS患者慢性银屑病反应的发展。牛皮癣的病原性抗原缺乏mDC和T细胞激活。
总而言之,我们的研究表明抗TNF诱导的HS感染患者具有悖论性牛皮癣具有早期牛皮癣常见的免疫学特征,主要特征在于先天免疫的细胞和分子作用。其中,LT-α和LT-β以及IFN-κ和IFN-λ1已被确定为可能与诱发悖论性牛皮癣有关的新的先天介体。值得注意的是,我们发现,除了pDC以外,角质形成细胞也是I型IFN(特别是IFN-β)的来源,很可能是TNF-α抑制的结果。评估抗TNF-α治疗对矛盾的牛皮癣样反应中角质形成细胞的影响,尤其是在I型IFN产生方面,以确定与牛皮癣早期有关的新的致病机制,具有重要意义。
