
前言
子宫肉瘤是一类恶性间叶组织源性肿瘤,约占所有女性生殖道恶性肿瘤的1%,占子宫体恶性肿瘤的3%~7%[1]。子宫肉瘤常缺乏特异性的临床表现,其病因也尚不明确,总体预后较差,I-II期的5年生存率为45~50%,晚期则骤降至0~15%[2]。子宫肉瘤组织类型复杂,子宫平滑肌肉瘤(uLMS)最为常见(40%~50%),其次为低级别子宫内膜间质肉瘤(LGESS)[1],其他罕见亚型亦有十多种。随着分子病理学的研究进展,基因检测方法也被应用于子宫肉瘤的评估[1],在诊断、预后和治疗中,具有重要的意义。
子宫肉瘤的诊断和分类
子宫肉瘤常缺乏特异性的临床表现,患者主要表现异常阴道出血、盆腔肿块、盆腔疼痛等,其病因也尚不明确。影像学无论是B超、CT、MRI或PET/CT,都难于在术前区分肿瘤的良恶性,许多患者就诊时常被诊断为子宫良性疾病,在术后病理学检查时才得以确诊为子宫肉瘤。诊断性刮宫或子宫内膜活检有助于诊断部分子宫内膜间质肉瘤(ESS),但敏感性较差,需要病理学诊断(形态学、免疫组织化学和分子诊断)的辅助[1]。

WHO子宫肉瘤分类[3]
子宫肉瘤的分子机制
uLMS是最常见的子宫肉瘤亚型,占子宫肉瘤的40%~50%,占所有子宫体恶性肿瘤的1%~2%。患者的症状和体征常与子宫平滑肌瘤相似,术前难于区分[1]。子宫平滑肌瘤与uLMS的比例约为800:1[1],仅组织学诊断缺乏可靠的预后,对于不典型的病例,应提倡分子检测技术[4]。uLMS中最常见的为普通型(梭形细胞型)LMS,其次为上皮样LMS,黏液型LMS最为罕见;三者主要通过形态学特征和核分裂象数量进行区分[1]。
前瞻性研究(NCT01775072)纳入107例子宫肉瘤患者,包括80例uLMS、22例高级别非平滑肌肉瘤(HG non-LMS)、4例LGESS和2例恶性潜能未定的平滑肌肿瘤(SMTUMP)。对肿瘤样本和匹配血液样本进行MSK-IMPACT和MSK-Fusion检测。发现uLMS常见TP53(56%)、RB1(51%)和ATRX(35%)的功能缺失性突变。有5%的患者存在BRCA2纯合缺失,与其他癌症相比频率较高,并且仅限于uLMS。PTEN变异在转移性样本中比在原发样本中更为常见(p=0.046)[5]。

子宫肉瘤突变图谱[5]
耶鲁大学牵头的一项研究纳入83个uLMS样本,研究提示TP53、MED12、PTEN基因存在热点突变,最常见的体细胞突变基因包括TP53、ATRX、PTEN和MEN1。TP53和ATRX突变与生存降低有关。检测出多种融合形式,ACTG2-ALK融合具有潜在的靶向性。拷贝数变异(CNV)分析确定了18.2%(12/66)的样本存在MYC扩增,另有7个拷贝数扩增和29个拷贝数丢失。25%(12/48)的新鲜冷冻uLMS具有同源重组修复缺陷(HRD)特征[6]。另一项研究通过高通量测序(NGS)分析了509例患者的525个样本,同源重组DNA损伤修复(HR-DDR)基因在28.2%的样本中发生了突变,最常见的突变基因是ATRX(18.2%)、BRCA2(4%)和RAD51B(2.6%),在uLMS中的突变频率最高(35.4%),在LGESS中的频率最低(2.9%)[7]。

TP53(左图)和ATRX(右图)突变与总生存率(OS)降低有关[6]
ESS较少见,包括以下两种类型:LGESS发病率不足整个子宫恶性肿瘤的1%,是第二常见的子宫间叶源性恶性肿瘤,仅次于uLMS;高级别子宫内膜间质肉瘤(HGESS)是极为罕见的高度恶性肿瘤[1]。约2/3的LGESS出现多个基因的融合,JAZF1-SUZ12融合最常见(>50%),其次是JAZF1-PHF1,EPC1-PHF1、MEAF6-PHF1融合,MBTD1-CXorf67、BRD8-PHF1、EPC2-PHF1和EPC1-SUZ12也有报道。LGESS相关融合的荧光原位杂交(FISH)或RNA靶向测序可以用于确诊。HGESS中最为常见的是YWHAE‑NUTM2 A/B基因融合,较为少见的是ZC3H7B-BCOR融合或BCOR 内部串联重复(ITD)[8]。
子宫肉瘤各亚型的常见变异[8]

子宫肉瘤的靶向治疗
除辅助分型、预后之外,NCCN指南推荐全面的基因组检测可用于转移性患者寻找泛癌种靶向治疗的机会。针对复发、转移、不可手术患者,NTRK基因融合阳性肿瘤可使用TRK抑制剂,ALK易位的IMT可使用ALK抑制剂,BRCA(主要为BRCA2)突变的LMS可使用PARP抑制剂等[8]。
在前瞻性研究(NCT01775072)中,48例患者(45%)发现了潜在的可操作突变,其中8例(17%)接受了匹配治疗,2例达到了临床反应。一例患者检出LBH-ALK融合,该患者接受了ALK抑制剂克唑替尼治疗,并在30个月以上影像学病情稳定。在具有体细胞 BRCA2 变异的uLMS患者中,含PARP抑制剂的治疗观察到持续的部分缓解[5]。
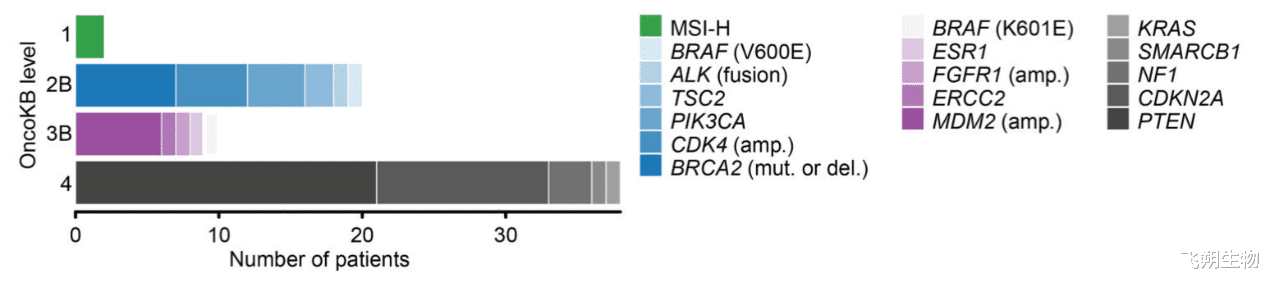
子宫肉瘤潜在疗效标志物[5]
耶鲁大学的研究发现Copanlisib(PI3K抑制剂)、奥拉帕利(PARP抑制剂)和GS-626510(C-MYC/BET抑制剂)在体内抑制 uLMS人源肿瘤组织异种移植模型(PDX)中的细胞增殖[6]。目前,奥拉帕利联合替莫唑胺治疗晚期uLMS的II 期临床研究(NCT03880019)正在进行中,初步数据表明,开始治疗后六个月内的客观缓解率(ORR)为22.7%[9-10]。亦有一些个例报道BRCA2基因体系突变的转移性uLMS患者,使用奥拉帕利治疗后疾病稳定[9][11]。
子宫肉瘤的检测方法
由于子宫肉瘤组织类型复杂,不同类型子宫肉瘤的免疫组织化学标志物之间有交叉表达,子宫肉瘤病理诊断规范指出对于有条件的单位建议开展分子检测,FISH、NGS为主要检测方法。对于既往一些未能分类的子宫肉瘤或者新出现的亚型分类,需要分子检测结果的支持才能诊断[12]。
基于连接依赖性逆转录聚合酶链式反应和靶向NGS法(LD-RT-PCR-NGS),在158个样本中检测137个基因的致癌融合转录本,研究包括1例HGESS、8例LGESS、2例PEComa。与FISH和RT-PCR相比,RNA-seq的一致率达到98.1%。尽管FISH检测简单而稳健,但一次只能检测一个融合基因。RT-PCR可以在一次检测中同时筛选多个融合基因,但其多重检测能力仍然受到限制。肉瘤的融合变异多样,因此需要进行多基因的联检,以便于协助临床对患者进行预后评估,并指导临床治疗方案[13]。
另一项回顾性研究入组42例形态学诊断为ESS,但通过FISH检测,JAZF1重排阴性(n=22),YWHAE重排阴性(n=11)或两者均阴性(n=9)的患者。使用RNA-seq在31例(74%)FISH阴性样本中发现了染色体融合。RNA-seq对12个病例(29%)重新分类,7例LGESS重分类为HGESS(n=2)、恶性上皮样肿瘤伴GLI1重排(n=2)、NCOA融合阳性子宫肿瘤(n=2)或子宫肌瘤(n=1),2例HGESS重分类为未分化子宫肉瘤(UUS),3例UUS重分类为HGESS、NTRK重排的子宫肉瘤和SDUS。RNA-seq可以对子宫肉瘤进行重新分类,并指导治疗策略[14]。

表达谱聚类分析和生存分析[14]
总结
子宫肉瘤组织类型和分子机制均较为复杂,NGS是主要检测方法之一。由于子宫肉瘤同时存在复杂的基因突变、CNV和基因融合,DNA和RNA水平共检成为刚需。子宫肉瘤融合基因检测的难点为未知融合的检测,已知融合基因可能位于5’端或3’端,融合伴侣众多,每种融合可能存在多种断点。采用单侧引物反转录的方式,在RNA水平上检测基因融合,可检未知融合且无需设计多对引物。
飞朔生物的子宫肉瘤基因检测项目DNA检测37个基因,含6个基因的CNV;RNA检测28个基因共129个常见断点的已知和未知的融合类型。飞朔致力于为肿瘤个体化精准医学检测提供最具创新性的产品和服务,并持续更新现有产品。
参考文献
[1] 子宫肉瘤诊断与治疗指南(2021年版)
[2] Pathology. 2007 Feb;39(1):55-71.
[3] 第五版WHO妇科生殖系统肿瘤分类
[4] Gynecol Oncol Rep. 2021 Nov 17:38:100890.
[5] Clin Cancer Res. 2020 Jul 15;26(14):3881-3888.
[6] Proc Natl Acad Sci U S A. 2021 Apr 13;118(15):e2025182118.
[7] Gynecol Oncol. 2023 Oct:177:14-19.
[8] NCCN子宫肿瘤诊疗指南2024 v3
[9] Gynecol Oncol Rep. 2022 Jul 14:42:101044.
[10] ClinicalTrials数据库
[11] Oncologist. 2019 Jul;24(7):973-979.
[12] 子宫肉瘤病理诊断规范
[13] Mod Pathol. 2022 May;35(5):649-663.
[14] Cancers (Basel). 2020 Sep 11;12(9):2604.
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!
