非小细胞肺癌(NSCLC)是全球癌症死亡的主要原因之一,其治疗方案的探索与革新始终是全球医疗领域关注的焦点。随着精准医疗时代的到来,针对特定基因突变的靶向疗法以及免疫疗法的兴起,为NSCLC患者带来了前所未有的治疗希望。
除了EGFR和ALK之外,NSCLC还有许多不常见但仍然重要的分子亚型,包括ROS1融合、MET外显子14跳跃突变、RET融合、NTRK融合和BRAF V600E突变等。本文基于摩熵咨询最新发布的《市场研究专题报告——非小细胞肺癌药物》部分精彩内容,旨在深入探讨BRAF/NTRK/MET/RET等少见靶点突变非小细胞肺癌(NSCLC)的诊疗指南及靶向药物的最新进展,以期为相关领域的研究者、临床医生及政策制定者提供有价值的参考。
一、少见靶点突变非小细胞肺癌(NSCLC)精准治疗1. ROS1融合阳性NSCLC靶向治疗
ROS1基因(c-ROS 肉瘤致癌因子-受体酪氨酸激酶),与 EGFR、ALK 均为非小细胞肺癌(NSCLC)明确的驱动基因,属于酪氨酸激酶胰岛素受体基因。ROS1基因发生致癌变异,会激活其下游通路的信号,造成细胞过度地生长及增殖,驱动肿瘤的发生。变异类型包括融合(重排)、点突变、扩增,其中融合是ROS1 基因主要变异类型。
ROS1融合在NSCLC中约为1%,主要发生在年轻(中位年龄50岁)、不吸烟的肺腺癌患者中。目前,在国内获批上市的ROS1抑制剂有4款:克唑替尼、恩曲替尼、富马酸安奈克替尼胶囊和第二代NTRK/ROS1抑制剂瑞普替尼,迈入全新“四足鼎立”时代。
辉瑞的克唑替尼是一种ALK/MET/ROS1抑制剂,是全球首款ALK激酶抑制剂,也是首个获FDA批准上市的ROS1抑制剂。BMS/再鼎医药的瑞普替尼于2023年11月获FDA批准上市,于2024年5月在国内获批上市。

目前,中国临床肿瘤学会(CSCO)的指南则推荐恩曲替尼和克唑替尼作为IV期ROS1融合阳性NSCLC患者的一线治疗选择,并给予一级推荐。
在2024CSCO指南中,ROS1融合阳性的晚期NSCLC的治疗,IV期ROS1融合NSCLC一线治疗部分:新增“Repotrectinib(瑞普替尼)作为Ⅲ级推荐。IV期ROS1融合 NSCLC后线治疗部分,新增“Repotrectinib”作为Ⅲ级推荐。
2. BRAF/NTRK/MET/RET突变NSCLC的临床需求与靶点药物进展
除了ROS1基因融合,在肺癌领域,目前已经确定的罕见突变靶点还有BRAF V600E突变、NTRK基因融合、MET 14号外显子跳跃突变、RET融合、KRAS G12C、EGFR 20号外显子插入突变等。
(1)非小细胞肺癌罕见突变有较大未满足的临床需求
罕见突变靶点药物因基因罕见或研发难度大,目前获批上市的药物不多,BRAF /NTRK/MET /RET 突变NSCLC仍有较大的为满足的临床需求。相信随着研发进展,未来将有更多靶向药问世。

(2)BRAF /NTRK/MET /RET靶点药物仍处于市场导入期
由于BRAF V600/NTRK/MET 14 外显子/RET靶点的NSCLC药物近两年刚上市,还处于市场导入阶段。
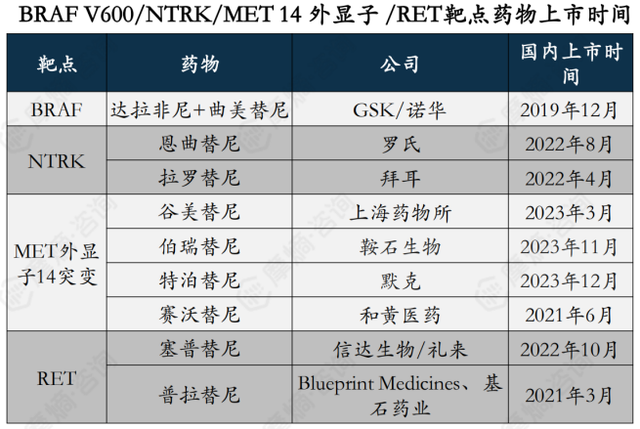
达拉非尼+曲美替尼首个适应症为黑色素瘤,2019年12月获批上市, NSCLC适应症为2021年4月获批上市。销售额额表现较好,2023年已达7.8亿元。
治疗MET外显子14突变药物中,赛沃替尼尽管为二级推荐,但销售额表现较好,2023年达4.11亿元,主要是上市时间较早,其他三款药物均2023年刚获批上市。

(3)BRAF突变NSCLC治疗推荐
NSCLC的BRAF突变率为2%-4%,其中最常见类型为BRAF V600突变。BRAF突变作为肺癌不良预后因子,传统化疗和免疫治疗对BRAF V600突变人群均疗效有限。多个靶向药物获批用于晚期NSCLC的同时,BRAF V600突变NSCLC患者却面临着长期无靶向药可用的困境。
随着达拉非尼+曲美替尼的双靶联合治疗方案于2022年3月获得国家药品监督管理局(NMPA)批准用于治疗BRAF V600E突变阳性的转移性NSCLC患者,BRAF V600突变也从既往的“无药可用”进入了“有靶有药”的时代。
在国内2024版CSCO指南中,达拉非尼+曲美替尼被列入I级推荐,成为我国BRAF V600突变晚期NSCLC患者的标准治疗方案。
(4)NTRK融合NSCLC治疗推荐
NTRK融合基因是近年来非小细胞肺癌(NSCLC)中备受关注的罕见驱动基因变异之一,其突变频率在中国肺癌人群中极低,仅占0.18%。NTRK突变的NSCLC最常见于具有腺癌组织学和最少吸烟的年轻患者。
在CSCO新版指南中,恩曲替尼、拉罗替尼作为一线治疗的推荐由原来的Ⅲ级推荐上调为Ⅰ级推荐(3类证据),一线治疗的Ⅱ级推荐继续参考Ⅳ期无驱动基因NSCLC一线治疗的Ⅱ级推荐部分,一线治疗的Ⅲ级推荐则变更为参考Ⅳ期无驱动基因NSCLC一线治疗的Ⅲ级推荐部分。
拉罗替尼于2018年被FDA批准用于携带NTRK基因融合的成人和儿童实体肿瘤患者。恩曲替尼于2019年被FDA批准用于12岁以上的存在NTRK融合的实体肿瘤患者的成人和儿童患者。
(5)MET 14外显子跳跃突变NSCLC治疗推荐
MET 14外显子跳跃突变在NSCLC中发生率为1%~3%,在肺肉瘤样癌中发生率则高达13%~22%。对于此类患者,新版指南一线治疗中,上调“特泊替尼”为I级推荐,新增“谷美替尼”“伯瑞替尼”作为I级推荐;一线治疗新增“赛沃替尼”为II级推荐。
特泊替尼于2021年2月3日获FDA加速批准,2023年12月获得NMPA批准用于治疗MET14 外显子跳跃突变的晚期或转移性NSCLC。谷美替尼、伯瑞替尼分别于2023年3月、11月获NMPA附条件批准用于MET 14外显子跳跃突变的局部晚期或转移性NSCLC的治疗。
伯瑞替尼(Vebreltinib)研发现状

图片来源:摩熵医药全球药物研发数据库
(6)RET 融合突变NSCLC治疗推荐
RET基因融合突变在NSCLC中的发生率为1%~2%,可诱导RET信号通路配体非依赖性激活,与MAPK通路改变互斥,但可与其他突变同时出现。
新版指南将“塞普替尼”的I级推荐的证据类型由3类改为1类,同时上调“普拉替尼”为I级推荐,后线推荐则变更为参考Ⅳ期无驱动基因NSCLC一线治疗的II/III级推荐部分。
塞普替尼于2022年9月获NMPA附条件批准用于治疗RET基因融合阳性NSCLC患者。普拉替尼于2023年6月获NMPA批准用于RET基因融合阳性NSCLC成人患者的一线治疗。
结语:非小细胞肺癌的治疗正在经历一场革新,从ROS1融合到BRAF、NTRK、MET、RET等少见靶点,每一种基因突变的发现都为患者带来了新的治疗曙光。尽管这些罕见突变的治疗药物尚处于市场导入期,但其临床价值的显现已不可小觑。未来,随着更多创新药物的研发与上市,以及治疗指南的不断更新与完善,NSCLC患者将拥有更多个性化、精准化的治疗选择,进一步提升生存质量与生存期。
<END>
