背景概述
新型冠状病毒感染性肺炎(COVID-19)加快了 mRNA 疫苗发展。mRNA 疫苗从概念阶段到成功商业化应用,得益于脂质纳米颗粒(LNP)递送系统的成功开发和大规模制备工艺的成熟。LNP 是现阶段最成熟、最有效的 mRNA 递送载体,最早上市的两款 mRNA 新冠疫苗均是采用的 LNP 递送形式。
传统LNP制备工艺
mRNA-LNP的递送原理:阳离子脂质与带负电荷的 mRNA 分子静电络合,形成复合体,提高 mRNA 分子的稳定性。
mRNA-LNP有多种制备方法,微流控技术相对简便快速,封装效率高,均一性和批间重复性好,容易实现放大生产。
在早研阶段,往往需要大量的靶点筛选、序列优化来确定符合设计需求的药物靶点、UTR 及 CDS 序列。
现阶段体内递送的mRNA-LNP 样品对起始包封样品需求量大,包封后需要复杂的下游超滤和纯化工艺。纯化后多种检测方法需要高精度仪器和繁琐的质检步骤,延缓了早研阶段 mRNA 序列筛选的进度。

突破传统!1min包封mRNA神器上线
针对以上痛点,瀚海新酶重磅推出即用型体内递送 LNP—Fast LNP(in vivo-系统递送):通过脂质组分间的疏水性和相互分子间作用,仅需简单手混即能自发组装成 mRNA-LNP。快速简便无需设备,操作简单无样品损耗,起始样本需求量低至 μg。且组分中不含有乙醇,安全性高,不需复杂的下游超滤和纯化工艺,无需复杂的样品质检流程。专为实验动物体内 RNA 递送开发的即用型 LNP 高效包封方案,利用 Fast LNP,可将动物体内验证的成本和周期大幅度降低,可跨过细胞水平验证,直接进行高精准、超快速、低成本、高安全性的mRNA 体内验证,广泛适用于 mRNA、gRNA、saRNA 等多种 RNA 类型。
高效1min包封mRNA
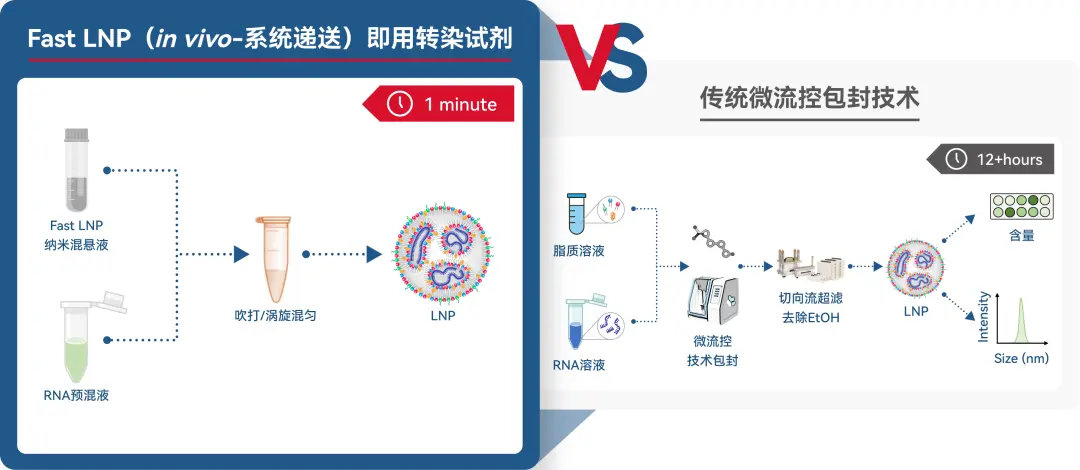
优势

应用场景
01 RNA药物动物体内评价
02 RNA序列体内高通量筛选
03 mRNA疫苗和药物研发
04 基因编辑效率分析
05 动物免疫和抗体制备
06 微量RNA的LNP包封
产品应用
应用本产品,可跨过细胞水平验证,直接进行超快速、低成本的体内验证。瀚海新酶可提供基于此产品的体内验证,直接输出体内表达效率结果,用专业的定制化方案推出优质的服务。
可满足多种给药方式的快速体内验证
(数据展示)
● 静脉注射
分别使用微流控制备的 LNP 和瀚海新酶的 Fast LNP(in vivo)进行尾静脉给药,单次给药剂量 30 μg /只,于 6h 后腹腔注射 D-荧光素钾盐,进行 IVIS 活体成像。结果显示,瀚海新酶 Fast LNP(in vivo)与微流控包封的 LNP 在肝脾组织的靶向效果相当。

设备包封LNP(左)Fast LNP(in vivo)(右)

● 肌肉注射
分别使用微流控制备的 LNP 和瀚海新酶的 Fast LNP(in vivo)进行肌肉给药,单次给药剂量 7.5 μg /只,于 6h 后腹腔注射 D-荧光素钾盐,进行 IVIS 活体成像。结果显示,瀚海新酶 Fast LNP(in vivo)与微流控包封的 LNP 在肝脾和肌肉的靶向效果相当。

设备包封LNP(左)Fast LNP(in vivo)(右)

● 腹腔注射
分别使用微流控制备的 LNP 和瀚海新酶的 Fast LNP(in vivo)进行腹腔给药,单次给药剂量 30 μg/只,于6h 后腹腔注射 D-荧光素钾盐,进行 IVIS 活体成像。结果显示,瀚海新酶 Fast LNP(in vivo)与微流控包封的 LNP 在肝脾组织的靶向效果相当。
● 皮下注射
分别使用微流控制备的 LNP 和瀚海新酶的 Fast LNP(in vivo)进行皮下给药,单次给药剂量 30 μg/只,于 6h 后腹腔注射 D-荧光素钾盐,进行 IVIS 活体成像。结果显示,瀚海新酶 Fast LNP(in vivo)与微流控包封的 LNP 在皮下的靶向效果相当,Fast LNP(in vivo)在肝脾组织的靶向效果略弱。

设备包封 LNP(左)Fast LNP(in vivo)(右边)

产品信息

