*仅供医学专业人士阅读参考

HIMALAYA研究4年OS率更新,STRIDE方案造福更多晚期HCC患者。
原发性肝癌是我国常见的恶性肿瘤之一,且具有明显异质性,其中肝细胞癌(HCC)占原发性肝癌的75%-85%[1]。早期HCC经过外科治疗后5年生存率超过60%[2],但是由于HCC患者发病隐匿,首次诊断时只有不到30%的患者适合接受根治性治疗,晚期HCC患者5年生存率仅为5%-9%[1,3]。近年来,随着免疫治疗和靶向治疗不断发展,逐渐改变着HCC的治疗格局,HIMALAYA研究更是以STRIDE方案开启HCC一线双免疫治疗新时代,可为众多晚期HCC患者带来生存获益,极大改善了HCC患者的整体生存状况。HIMALAYA研究,开启HCC一线双免疫治疗新里程HIMALAYA研究[5]是一项全球多中心、开放标签的Ⅲ期临床研究,纳入人群为初诊不可切除的HCC患者,按1:1:1分别接受度伐利尤单抗(每4周1500mg)单药治疗、STRIDE方案(在度伐利尤单抗1500mg每4周1次常规治疗基础上添加使用一剂替西木单抗 300mg)或索拉非尼(400mg,每日2次)。该研究数据显示:STRIDE方案组中位总生存期(mOS)为16.4个月,索拉非尼组为13.8个月,死亡风险降低了22%(HR=0.78,95%CI 0.65-0.93),STRIDE方案组3年OS率提高了50%(30.7% vs 20.2%,索拉非尼组有22.9%的患者后续接受了免疫治疗);
STRIDE方案组客观缓解率(ORR)较索拉非尼组提高了3倍(20.1% vs 5.1% ),缓解持续时间(DOR)长达22.3个月,即STRIDE方案给患者带来了持久的免疫应答、长久的生存获益,具有免疫治疗独有的长拖尾效应;亚洲亚组数据显示中国香港和台湾地区患者共纳入141例患者,接受STRIDE方案治疗的患者mOS达29.4个月,死亡风险降低了56%(HR=0.44,95%CI 0.26-0.77),三年生存率达49.2%[6];安全性方面,STRIDE方案组未发现新的安全性信号,3/4级治疗相关不良反应(TRAE)发生率低于索拉非尼组(25.8% vs 36.9%),且未增加严重肝毒性和出血风险。今年美国临床肿瘤学会(ASCO)会议上进一步公布了HIMALAYA研究中STRIDE方案的安全性数据分析[6]:STRIDE方案组出现免疫介导的不良事件(imAEs)的发生率为35.8%,而度伐利尤单抗组为16.5%。尽管STRIDE方案组的imAE发生率高于度伐利尤单抗组,但两组的imAE严重程度及时间模式相似。STRIDE方案组的imAE大多发生于治疗后3个月内,且多为1-2级,经对症治疗后缓解,鲜有imAE导致的停药事件发生。
STRIDE方案组中,相较未发生imAE的患者,发生imAE患者的mOS延长9.1个月(23.2个月 vs 14.1个月,HR=0.73,95%CI 0.56-0.95);进一步分析各组36个月OS率,研究者发现,虽然在STRIDE方案组中未发生imAE的患者的36个月OS率低于发生imAE的患者(27.7% vs 36.2%),但其与意向治疗人群(ITT)STRIDE方案组的36个月OS率相似(30.7%),并优于索拉非尼组(20.2%)。综上所述,imAE的发生率不会影响STRIDE方案的OS获益,且无论患者是否发生imAE,患者均可从STRIDE方案中长期获益。2023年6月29日,由欧洲肿瘤内科学会(ESMO)主办的2023年世界胃肠道肿瘤大会(WCGIC)会议上公布了HIMALAYA研究4年OS数据[7]:STRIDE方案组4年OS率为25.2%,较索拉非尼组提高了67%(25.2% vs 15.1%)(图1);
在获得疾病控制的患者中,STRIDE方案组的4年OS率为36.2%,较索拉非尼组提高了78%(36.2% vs 20.3%)(图2.右);在不同病因(HBV、HCV或非病毒)导致的HCC患者中,STRIDE方案组相较索拉非尼组,OS均有不同程度改善(图3);无论是完全缓解(CR)、部分缓解(PR)或者疾病进展(PD)的患者,STRIDE方案组相较索拉非尼组,OS均有不同程度改善(图2.左);安全性方面,STRIDE方案组在主要分析后没有发生新的严重TRAEs。 图1. HIMALAYA研究中STRIDE方案组与索拉非尼组4年OS率
图1. HIMALAYA研究中STRIDE方案组与索拉非尼组4年OS率 图2. HIMALAYA研究中STRIDE方案组与索拉非尼组在不同疾病状态下的4年OS率
图2. HIMALAYA研究中STRIDE方案组与索拉非尼组在不同疾病状态下的4年OS率 图3. HIMALAYA研究中STRIDE方案组与索拉非尼组在不同病因学下4年OS的HR(95% CI)HIMALAYA研究的成功,表明双免疫治疗首次在HCC一线治疗领域实现了突破,开启了HCC一线双免疫治疗新里程,而4年OS率的更新,更是夯实了STRIDE方案可为晚期HCC患者提高生存获益。STRIDE方案独具匠心,改善HCC患者长期生存基于Ⅲ期临床研究HIMALAYA的阳性结果,度伐利尤单抗联合替西木单抗于2022年被美国食品药品监督管理局(FDA)获批用于治疗不可切除的肝细胞癌成年患者。也是基于以上结果,《中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南(2022)》[8]的更新中,将度伐利尤单抗联合替西木单抗列入了晚期HCC的一线治疗的Ⅰ级推荐(1A类证据)。2018年诺贝尔生理学或医学奖的获得者詹姆斯·艾利森研究发现,如果暂时抑制T细胞表面表达的CTLA-4这一免疫系统“分子刹车”的活性,就能提高免疫系统对肿瘤细胞的攻击性。这个发现,为癌症治疗开创了全新的免疫治疗思路——释放免疫系统自身的能力来攻击肿瘤细胞(图4)。STRIDE方案由IgG2亚型CTLA-4抑制剂替西木单抗以及PD-L1抑制剂度伐利尤单抗构成,两者分别通过阻断淋巴结T细胞激活信号的抑制,减少肿瘤微环境中PD-1/PD-L1相互作用,恢复肿瘤免疫,进而发挥协同的抗肿瘤作用。此外,既往研究提示IgG2亚型CTLA-4抑制剂可与FcγR结合,通过髓系细胞的结合和I型IFN信号驱动免疫快速重塑,并驱动髓系细胞再次编程。在安全性方面,较IgG1亚型,IgG2亚型单抗的CDC及ADCC效应更低,因此STRIDE方案在有效抑制肿瘤的同时其安全性良好、可控。有研究显示,87.5%的HCC患者由HBV感染所致[9],而最近有研究发现,血清CTLA-4水平与HBV导致的HCC风险呈正相关(图5),阻断CTLA-4可以促进抗HBV反应,改善疾病预后,而替西木单抗作为一种CTLA-4抑制剂,可用于HBV病因导致的HCC患者,有效改善其预后[10]。STRIDE方案的优势在于替西木单抗只是一次单剂300mg的触发,不仅可以高效刺激T细胞激活,促使效应T细胞杀伤肿瘤细胞;也可以减少替西木单抗毒副作用,发挥治疗方案的“高效低毒”优势,为患者带来生存获益。这在肿瘤领域的用药方式也是独具匠心的,STRIDE方案为HCC患者带来了更广阔的治疗前景,即使HCC患者在病情进展后,仍有药可用。
图3. HIMALAYA研究中STRIDE方案组与索拉非尼组在不同病因学下4年OS的HR(95% CI)HIMALAYA研究的成功,表明双免疫治疗首次在HCC一线治疗领域实现了突破,开启了HCC一线双免疫治疗新里程,而4年OS率的更新,更是夯实了STRIDE方案可为晚期HCC患者提高生存获益。STRIDE方案独具匠心,改善HCC患者长期生存基于Ⅲ期临床研究HIMALAYA的阳性结果,度伐利尤单抗联合替西木单抗于2022年被美国食品药品监督管理局(FDA)获批用于治疗不可切除的肝细胞癌成年患者。也是基于以上结果,《中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南(2022)》[8]的更新中,将度伐利尤单抗联合替西木单抗列入了晚期HCC的一线治疗的Ⅰ级推荐(1A类证据)。2018年诺贝尔生理学或医学奖的获得者詹姆斯·艾利森研究发现,如果暂时抑制T细胞表面表达的CTLA-4这一免疫系统“分子刹车”的活性,就能提高免疫系统对肿瘤细胞的攻击性。这个发现,为癌症治疗开创了全新的免疫治疗思路——释放免疫系统自身的能力来攻击肿瘤细胞(图4)。STRIDE方案由IgG2亚型CTLA-4抑制剂替西木单抗以及PD-L1抑制剂度伐利尤单抗构成,两者分别通过阻断淋巴结T细胞激活信号的抑制,减少肿瘤微环境中PD-1/PD-L1相互作用,恢复肿瘤免疫,进而发挥协同的抗肿瘤作用。此外,既往研究提示IgG2亚型CTLA-4抑制剂可与FcγR结合,通过髓系细胞的结合和I型IFN信号驱动免疫快速重塑,并驱动髓系细胞再次编程。在安全性方面,较IgG1亚型,IgG2亚型单抗的CDC及ADCC效应更低,因此STRIDE方案在有效抑制肿瘤的同时其安全性良好、可控。有研究显示,87.5%的HCC患者由HBV感染所致[9],而最近有研究发现,血清CTLA-4水平与HBV导致的HCC风险呈正相关(图5),阻断CTLA-4可以促进抗HBV反应,改善疾病预后,而替西木单抗作为一种CTLA-4抑制剂,可用于HBV病因导致的HCC患者,有效改善其预后[10]。STRIDE方案的优势在于替西木单抗只是一次单剂300mg的触发,不仅可以高效刺激T细胞激活,促使效应T细胞杀伤肿瘤细胞;也可以减少替西木单抗毒副作用,发挥治疗方案的“高效低毒”优势,为患者带来生存获益。这在肿瘤领域的用药方式也是独具匠心的,STRIDE方案为HCC患者带来了更广阔的治疗前景,即使HCC患者在病情进展后,仍有药可用。 图4.
图4.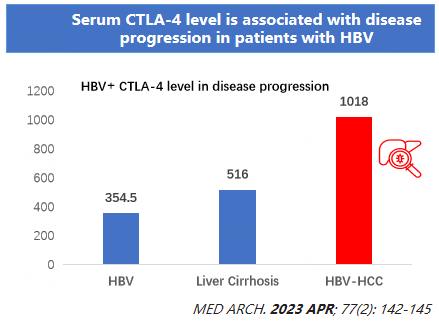
图5
随着现代医学的不断发展,免疫治疗、靶向治疗及联合治疗在晚期HCC领域开辟了肿瘤治疗新局面,为晚期HCC患者带来治疗可选择性和临床生存获益。尽管目前晚期HCC一线标准治疗已有了较丰富的选择,但我国患者基数庞大,仍存在明显未被满足的临床需求。HIMALAYA研究中,STRIDE方案不仅显著优效于索拉非尼标准治疗,且总体安全性和耐受性良好,最新公布的4年OS率更是达到25.2%,意味着在全球约有四分之一的晚期HCC患者生存时间达到4年;而在疾病得到控制的患者中,4年OS率达到36.2%;安全性方面未出现严重的TRAEs,为晚期HCC患者带来新的治疗选择,将生命的长度延长到“治愈”。参考文献:
[1].国家卫生健康委办公厅. 原发性肝癌诊疗指南(2022年版)[J]. 临床肝胆病杂志, 2022, 38(2):288-303.[2].贺庆,刘坤,王超红,张靖雨.《原发性肝癌诊疗指南(2022年版)》解读[J].西部医学,2023,35(04):474-479.[3].翁敏代正燕王昆华.肝癌患者不同疾病状态时的营养治疗[J].肿瘤代谢与营养电子杂志, 2022, 9(1):1-6.[4].GK ABOU-ALFA,SL CHAN,M KUDO, et al. A randomized, multicenter phase 3 study of durvalumab (D) and tremelimumab (T) as first-line treatment in patients with unresectable hepatocellular carcinoma (HCC): HIMALAYA study.2022 ASCO Gastrointestinal Cancers Symposium[J]. J Clin Oncol, 2022, 40 (4 suppl): Abstrct 379.[5].Chan SL, Kudo M,Sangro B, et al. Outcomes in the Asian subgroup of the phase III HIMALAYA study of tremelimumab (T) plus durvalumab (D) in unresectable hepatocellular carcinoma (uHCC).2022 ESMO ASIA, Abstrct 670.[6].Lau G, Cheng AL, Sangro B, et al. Outcomes by occurrence of immune-mediated adverse events with tremelimumab plus durvalumab in the Phase 3 HIMALAYA study in unresectable hepatocellular carcinoma. 2023 ASCO. Abstract 4004.[7].Bruno S, Stephen L, Robin KK, et al.Four-year overall survival update from the phase 3 HIMALAYA study of tremelimumab plus durvalumab in unresectable hepatocellular carcinoma.2023 WCGIC.Abstract SO-15.[8].《CSCO原发性肝癌诊疗指南(2022)》[9].Darmadi D, Lindarto D, Siregar J, et al. Association Between Serum Cytotoxic T Lymphocyte Antigen (CTLA)-4 Level and Disease Progression in Patients With Chronic Hepatitis B. Med Arch. 2023 Apr;77(2):142-145.[9].Yang F, Ma L, Yang Y, et al. Contribution of Hepatitis B Virus Infection to the Aggressiveness of Primary Liver Cancer: A Clinical Epidemiological Study in Eastern China. Front Oncol. 2019 May 21;9:370.
[10].Darmadi D, Lindarto D, Siregar J, et al. Association Between Serum Cytotoxic T Lymphocyte Antigen (CTLA)-4 Level and Disease Progression in Patients With Chronic Hepatitis B. Med Arch. 2023 Apr;77(2):142-145.
* 此文仅用于向医学人士提供科学信息,不代表本平台观点

