在神经肿瘤治疗领域,胶质母细胞瘤(GBM)一直是我们面临的棘手难题。其恶性程度高,侵袭性强,即便历经手术、放疗、化疗等综合治疗,患者的预后依旧不佳,5年生存率始终处于低位。RNA干扰(RNAi)疗法的出现,为GBM的治疗带来了新希望,然而,从理论到临床的转化之路却充满坎坷。中国科学院生物物理研究所范克龙和阎锡蕴团队通过铁蛋白设计了一种能够靶向脑胶质瘤的siRNA递送系统,相关成果于2月19日发表在Science Advances。

01、RNAi疗法的潜力与挑战
RNAi疗法的潜力:RNAi疗法是一种极具潜力的肿瘤基因特异性治疗方法,其核心效应分子小干扰RNA(siRNA),能够精准识别并结合靶mRNA序列,在核酸酶作用下将其降解,实现对特定基因表达的高效调控。这一特性为攻克GBM提供了有力的分子生物学工具,有望从基因层面阻断肿瘤发生发展的关键通路。
面临的挑战:siRNA属于亲水性分子,难以自主跨越由脂质双分子层构成的细胞膜,无法顺利进入细胞内部发挥作用;siRNA分子量较小,在血液循环中极易被肾脏过滤清除,导致其在体内的半衰期极短,难以维持稳定的治疗浓度;细胞通过内吞作用摄取siRNA后,siRNA往往被困在内体/溶酶体中。内体/溶酶体内部富含多种水解酶,会迅速将siRNA降解,使其在发挥基因沉默功能前就被破坏;siRNA缺乏主动靶向肿瘤细胞的能力,在体内分布广泛,难以特异性富集于肿瘤部位,不仅降低了治疗效果,还可能引发全身不良反应。
02、铁蛋白成为解决方案的新希望
铁蛋白是一种广泛存在于生物体内的天然蛋白质,具有独特的中空球形结构,恰似一个天然的纳米级药物载体。其pH介导的可逆拆卸/组装特性,使其能在不同环境条件下动态改变结构,在中性环境中保持稳定的组装状态,而在酸性环境下发生解聚,这一特性为药物的可控释放提供了可能。
人重组重链铁蛋白(HFn)具有独特的靶向功能,能够特异性识别并结合高表达转铁蛋白受体1(TfR1)的肿瘤细胞。TfR1在GBM细胞表面高度表达,这使得HFn能够精准地将药物递送至肿瘤细胞。此外,HFn还具备穿越血脑屏障的能力,能够跨越这一阻碍药物进入脑组织的生理屏障,将携带的药物输送至胶质瘤部位。此前研究通过对铁蛋白进行修饰,已成功提高其核酸负载能力,但对于RNAi疗法而言,铁蛋白还需具备从溶酶体逃逸的能力,才能确保siRNA顺利进入细胞质发挥作用。
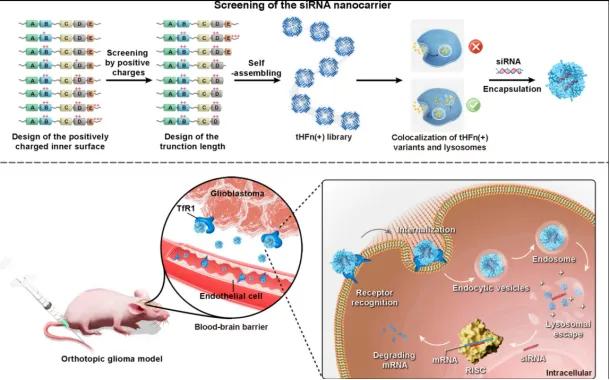
图1 用于神经胶质瘤靶向治疗的siRNA@tHFn(+)示意图
03、tHFn(+)变体的设计
内部空腔改造:在对RNAi疗法困境及铁蛋白特性深入研究后,科研团队将优化重点放在提升铁蛋白对siRNA的负载能力上。经分析发现,铁蛋白内部存在大量带负电的氨基酸,这些负电荷会与同样带负电的siRNA相互排斥,严重阻碍负载过程。为解决此问题,科研人员借助计算机辅助设计,对铁蛋白的氨基酸序列进行全面分析。他们从众多带负电氨基酸中,筛选出位于铁蛋白内表面且对整体结构影响较小的位点。带负电氨基酸主要是谷氨酸和天冬氨酸,每个HFn亚基包含多个此类氨基酸,经过层层筛选,确定了七个关键突变位点。考虑到空间位阻等因素,选用精氨酸和赖氨酸这两种带正电氨基酸进行替换。经过多次模拟与尝试确定了E61K+E64R+E140K+E147K+D177K+D179K+E181K的突变方案,成功得到HFn(+),其内部空腔带正电,与siRNA的静电吸引力增强,负载效率显著提高。
C末端截短:为进一步优化铁蛋白载体性能,科研团队又开展了C末端截短工作。他们设计了一系列截短的HFn(+)变体。C末端截短不仅能扩大铁蛋白内部空间,使其能容纳更多siRNA,还能改变铁蛋白的组装特性。铁蛋白的(C-3-C-4)界面在组装中起关键作用,截短C末端可影响该界面相互作用。研究发现,截短后的变体在弱酸环境下稳定性降低,更容易分解。这一特性恰好符合内体/溶酶体的酸性环境,为siRNA从内体/溶酶体逃逸提供了可能。这些变体在大肠杆菌中通过基因工程技术成功表达,随后利用阴离子交换色谱(AIEX)初步分离,再经疏水相互作用色谱(HIC)进一步纯化,最后通过尺寸排阻色谱(SEC)确定其纯度和寡聚状态。利用动态光散射(DLS)测定粒径,透射电子显微镜(TEM)观察结构形态,SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测蛋白质纯度,Native-PAGE分析自组装能力。经过一系列表征分析,最终确定即tHFn(+)各项性能最佳,用于后续深入研究。
04、tHFn(+)的溶酶体逃逸机制探究
(一)酸响应特性在筛选出最佳的siRNA纳米载体tHFn(+)后,研究其溶酶体逃逸机制成为关键。研究人员先采用Cy5.5标记的tHFn(+)变体处理U87MG细胞,3 h后用共聚焦激光扫描显微镜观察,计算皮尔逊相关系数(PCC),发现tHFn(+)与溶酶体的共定位程度低,显示出显著的溶酶体逃逸能力。
为深入了解tHFn(+)的溶酶体逃逸机制,研究人员开展了一系列实验。Native-PAGE实验表明,HFn在pH=4时开始分解,而tHFn(+)在pH=6时就出现分解迹象。TEM图像直观呈现出tHFn(+)在不同pH环境下的结构变化,在pH=7时保持完整球形,pH=6时结构开始松散,pH=4时完全分解。同时,zeta电位分析显示,随着pH从6降至5,tHFn(+)外表面电荷由负变正,这表明其结构在酸性环境下发生了明显改变。
(二)结构解析为从分子层面揭示tHFn(+)在弱酸性环境中的分解机制,研究人员利用冷冻电镜(cryo-EM)解析其蛋白质结构。经过对大量显微图像和粒子的处理分析,最终获得分辨率达1.73Å的tHFn(+)结构。结果显示,tHFn(+)由24个亚基组成球形结构,与野生型HFn主链均方根偏差仅为0.20Å,结构近乎一致。但在C末端,由于第五个螺旋截短,tHFn(+)四重孔更大。而且,tHFn(+)整体界面氢键比HFn弱,尤其是C3-C4界面中亚基之间的氢键明显减弱。这些结构差异赋予tHFn(+)弱酸响应性结构转变特性,使其在内体酸性环境(pH处于6.0~6.5)中更易解离,暴露内部正电荷,进而破坏内体,实现封装siRNA的释放。
05、tHFn(+)的实验验证与优势展现
(一)体内外实验验证在体外细胞实验中,研究人员将tHFn(+)与不同的siRNA结合,处理GBM细胞系。结果显示,tHFn(+)能够显著增强细胞对siRNA的摄取效率,且有效抑制与GBM进展密切相关的基因表达,如参与肿瘤细胞增殖、迁移和侵袭的关键基因。这表明tHFn(+)作为载体,能够高效地将siRNA递送至细胞内,并使其发挥基因沉默作用。
在体内动物实验中,研究人员构建了GBM动物模型,通过尾静脉注射等方式给予siRNA@tHFn(+)。借助活体成像技术,清晰观察到tHFn(+)能够成功穿越血脑屏障,精准地将siRNA递送至大脑中的肿瘤部位,实现对肿瘤细胞的靶向作用。
(二)对比优势研究人员将siRNA@tHFn(+)与传统的脂质纳米颗粒(LNPs)封装的siRNA进行对比。动物实验数据表明,siRNA@tHFn(+)在体内对胶质瘤的生长抑制效果更为显著。经过一段时间的治疗,接受siRNA@tHFn(+)治疗的动物肿瘤体积明显小于接受LNPs封装siRNA治疗的动物。同时,siRNA@tHFn(+)能够更有效地敲低靶基因,降低肿瘤细胞的增殖活性,抑制肿瘤血管生成,诱导肿瘤细胞凋亡,从而显著延长GBM模型动物的生存期。此外,tHFn(+)作为蛋白质纳米载体,具有良好的生物相容性和低免疫原性,在体内不会引发明显的免疫反应,安全性更高,这为其临床应用提供了重要优势。
06、研究展望与临床应用挑战
这项研究为GBM的治疗带来了新曙光,tHFn(+)作为通用的siRNA纳米载体,展现出卓越的性能,有望推动RNAi疗法在GBM及其他多种疾病治疗中的应用。其成功构建为RNAi疗法的临床转化提供了重要的技术支撑,为攻克GBM等恶性肿瘤带来了新的希望。
当然,从实验室到临床还有很长的路要走。首先,需要开展大规模的临床试验,进一步验证siRNA@tHFn(+)在人体中的安全性和有效性,评估其长期疗效和潜在的不良反应。其次,优化生产工艺,提高tHFn(+)的产量和质量稳定性,降低生产成本,以满足临床大规模应用的需求。此外,还需要深入研究siRNA@tHFn(+)在体内的药代动力学和药效学特性,制定合理的给药方案。但这一研究成果无疑为我们神经科医生提供了新的治疗思路和方向,期待未来能看到更多基于此的临床突破,为患者带来更多希望。让我们共同关注这一领域的发展,积极探索更多治疗可能。
