
成果简介
利用高浓度电解液(HCEs)的概念已被广泛纳入电解液设计,因为与稀释的电解液相比,它们具有增强的锂金属钝化和氧化稳定性。然而,高粘度和次优润湿性等问题影响了其商业化应用。基于此,加州大学圣地亚哥分校陈政教授和孟颖教授(共同通讯作者)等人为电池中的HCE系统引入了一种策略,该策略与锂(Li)和硫化聚丙烯腈(SPAN)兼容,同时确保了广泛的工作温度窗口。采用超低粘度溶剂二甲醚(Me2O),提高了电解液的离子电导率,该溶剂在25 ℃时通常处于气相状态,蒸汽压为593 kPa。鉴于Me2O具有较强的Li+溶剂化能力,假定锂盐的存在可以显著提高Me2O的沸点,这种升高归因于Li+离子和Me2O分子之间的离子偶极相互作用的稳定作用。这些相互作用导致溶剂的挥发性降低,从而提高其沸点,作者把这种现象称为“库仑凝聚”。实验证实,Me2O可以在常压下与二氟磺酰亚胺锂(LiFSI)盐缩合。这种LiFSI-Me2O组合可以形成常压稳定的液化气电解液。饱和LiFSI在Me2O中的浓度(Sat. LiFSI-Me2O)在-60 ℃~60℃范围内保持稳定,并且对比4 M LiFSI-DME(4 M LiFSI-DME)中的热稳定性有了提高,后者的LiFSI:醚摩尔比为1: 2.4。此外,Sat. LiFSI-Me2O电解液在20 ℃时具有相对的粘度和离子电导率(> 5.5 mS cm-1),对比4 M LiFSI-DME,在零度以下的温度下粘度大大降低,离子电导率提高。得益于醚的良好还原稳定性和盐衍生SEI的形成,Li金属可以在1000次循环中实现99.2%的平均CE的稳定循环。当与SPAN电极配对时,多余的Li/SPAN电池在200次循环中表现出超过92%的容量保持率,主要是由于减少了多硫化物的溶解和盐衍生的SEI/CEIs的形成。使用Sat. LiFSI-Me2O电解液的电池在有限的锂储层下也能承受高达6 mA cm-2的高电荷电流密度。本研究表明液化气电解液中的“库仑凝聚”可以形成稳定、高导电性的醚基溶液,从而提高锂金属电池的性能。

相关工作以《Coulombic Condensation of Liquefied Gas Electrolytes for Li Metal Batteries at Ambient Pressure》为题发表在最新一期《Angewandte Chemie International Edition》上。
陈政,加州大学圣地亚哥分校教授,2007年本科毕业于天津大学,博士师从加州大学洛杉矶分校卢云峰教授,随后在斯坦福大学从事博士后研究工作(导师:鲍哲南院士和崔屹院士);2016年加入加州大学圣地亚哥分校。长期从事储能与催化材料的研究和开发,超低温电池,锂离子电池回收以及电池安全设计。2021年9月24日,陈政和孟颖教授以通讯作者发表Science。

图文导读
在标准温度和压力(STP)条件下,以气态存在(STP沸点为-28 ℃)的Me2O作为溶剂。Me2O在液化气溶剂中表现出更高的LiFSI盐的溶解度,这是由于其更极性的醚官能团。首先将LiFSI盐装入高压窗口电池,然后填充Me2O气体,产生低浓度(约1 M)的透明溶液。通过在10 min内从电池中缓慢释放Me2O气体,降低系统压力,溶液中的LiFSI盐浓度增加。当气体完全释放时,观察到常压下的稳定液体,测量到盐: 醚的摩尔比为1: 2.36。所提出的溶剂化结构包含的游离Me2O分子明显较少,相反具有相当数量的Li+-FSI—-Me2O聚集体。
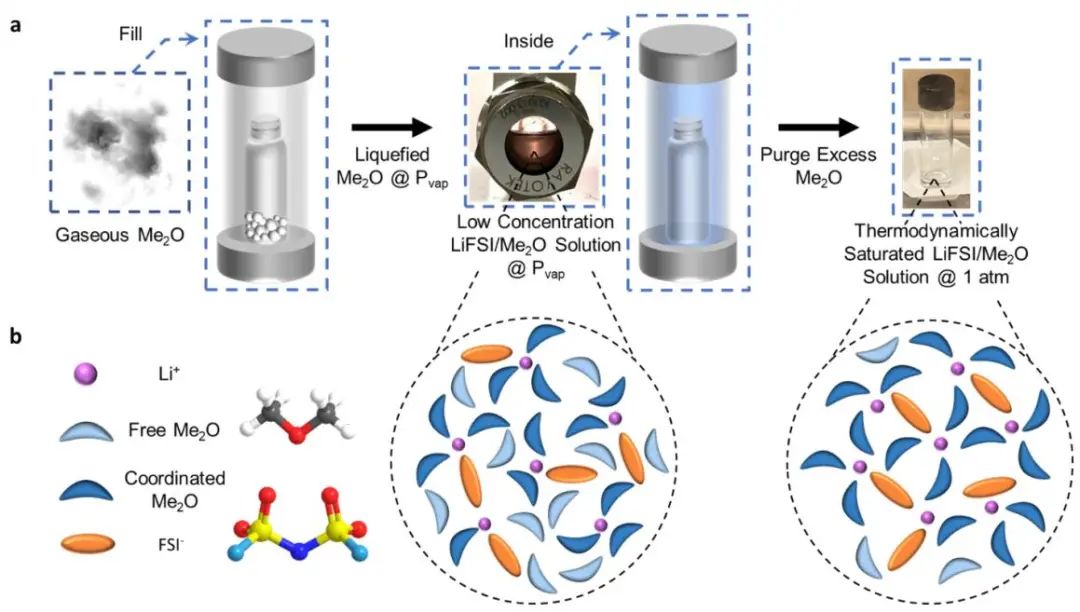
图1.凝聚电解液的设计

图2.不同电解液的物理和电化学性质
通过分子动力学(MD)模拟,作者分析了DME和Me2O电解液在一定范围内的分子比,以阐明LiFSI-Me2O配合物的形成机制。作者预测了Me2O: LiFSI体系在20: 1至2: 1的摩尔比下的缩合行为,对应于从稀盐浓度到相对高盐浓度的范围。然后,在1 bar的施加压力下进行研究,并由等温-等压的诺斯-胡佛正压器管理。作者观察到在Me2O: LiFSI ≤ 2.3: 1时,体系摩尔比在2 ns内急剧增加到~1.02 g mL-1,而其他体系的总密度都保持在<< 0.1 g mL-1。当检查轨迹时,发现在盐溶解的驱动下,Me2O: LiFSI为2.3: 1时有利凝聚进入液相。
图3.溶剂化结构和MD模拟结果
在0.5 mA cm-2电流密度下,作者测试了4 M LiFSI-DME、Sat. LiFSI-Me2O和Sat. LiFSI-DME基Li||Cu电池性能。在室温下,4 M LiFSI-DME和Sat. LiFSI-Me2O体系均显示出超过1000次的锂金属负极循环。其中,Sat. LiFSI-DME系统表现出更显著的循环波动,主要是由于其高粘度。使用4 M LiFSI-DME和Sat. LiFSI-Me2O的Li半电池在-20 ℃、-40 ℃和50 ℃循环时,Sat. LiFSI-Me2O体系的CE值分别保持在98.4%、98.4%和99.0%。
此外,使用Sat. LiFSI-Me2O的电池即使在12 mA cm-2的临界电流密度下也能表现出稳定的循环。当电流达到3 mA cm-2时,使用Sat. LiFSI-DME的电池发生短路,使用4 M LiFSI-DME的电池的CE下降到95.5%,表明Sat. LiFSI-Me2O电解液的性能。在室温下,以3 mA cm-2在两种电解质中沉积3 mAh cm-2后,分析了第一次循环镀锂的截面和表面形貌。虽然这两种体系都表现出局部致密的表面结构和块状的锂块,但4 M LiFSI-DME体系在沉积的锂中表现出更大的厚度增长和更大的孔隙度。在Sat. LiFSI-Me2O体系中镀的锂表现出更少的空隙和异常致密的形貌。

图4. Li/Cu电池的电化学循环性能
使用4 M LiFSI-DME的全电池在达到80%的容量保留率时,循环次数不到50次,而使用Sat. LiFSI-Me2O的全电池即使在200次循环后仍保持85%以上的容量保留率。在-20 °C时,Sat. LiFSI-Me2O电解液使Li/SPAN全电池在60次循环后保持280 mAh g-1,而使用4 M LiFSI-DME的全电池几乎没有放电容量。在-40 ℃下,Sat. LiFSI-Me2O电解液在充放电时仍能保持50%的室温放电容量。在50 °C下,具有Sat. LiFSI-Me2O和4 M LiFSI-DME的全电池在50次循环后分别保持了97%和46%的容量。
此外,在限定50 µm锂金属负极下,对于在4 M LiFSI-DME中循环的Li||SPAN全电池,在30次循环后显示出严重的容量衰减,而Sat. LiFSI-Me2O系统在100次循环中能够提供一致的循环性能。对比4 M LiFSI-DME,Sat. LiFSI-Me2O电解质显示出最小的多硫化物溶解,可能是由于Li+和Me2O之间的配位较弱,从而减少了Li-S离子键的解离。结果表明,在Li/SPAN电池中,Sat. LiFSI-Me2O在多个性能指标上优于4 M LiFSI-DME。


图6. Li/SPAN电池在第60次循环时Li和SPAN的界面分析
文献信息
Coulombic Condensation of Liquefied Gas Electrolytes for Li Metal Batteries at Ambient Pressure. Angew. Chem. Int. Ed., 2024, https://doi.org/10.1002/anie.202420411.
