
HCC患者四线治疗过程,最终近达CR
撰文 | 小隐近年来,免疫药物治疗晚期肝细胞癌(HCC)的疗效已在多项试验中得到证实。比如,在IMbrave150研究结果显示,阿替利珠单抗联合贝伐珠单抗一线治疗晚期HCC展示出令人满意的疗效,成为一线标准治疗方案。然而,免疫治疗耐药后的治疗策略尚不明确。近些年,随着不同靶点的免疫治疗药物问世,有学者尝试在不同药物之间进行切换治疗,以解决耐药问题。
2023年3月23日,JOURNAL OF LIVER CANCER上发布了一篇案例,关于肝癌一线PD-L1单抗免疫联合治疗失败后,后线再次挑战其他免疫治疗药物,疗效几乎达完全缓解(CR)的真实病例。医学界肿瘤频道特整理病例内容,进行分享学习。
一线:阿替利珠单抗+贝伐珠单抗二线:索拉非尼+放疗三线:瑞戈非尼四线:联合方案,6个月后转移灶几乎消失欲知具体诊疗过程和“逆转结局”诊疗方案,请看下文。一线选用阿替利珠单抗+贝伐珠单抗,治疗第四周时疾病进展HCC是肝癌的主要组织学亚型,占原发性肝癌的90%[1]。大多数HCC在诊断时已处于晚期,无法治愈。然而,针对肝功能差、广泛转移的晚期HCC患者治疗方法有限,这部分患者很难实现痊愈。随着近年来免疫治疗药物的崛起,免疫联合方案已成为一线治疗方案,晚期肝癌迎来了新治疗选择。
文中描述的是一例44岁的男性患者,既往患者每日服用恩替卡韦(0.5mg),因占位较大的肝脏肿瘤入院就诊。核磁共振成像(MRI)显示结果为约21.9cm的浸润性HCC伴右门静脉癌栓(PVTT)的形成及多发性肺转移(图1、2A)。


检查结果显示,患者初始甲胎蛋白(AFP)水平>100000 ng/mL,异常凝血酶原(PIVKA-II)水平为23230 mAU/mL(图3)。同时,Child-Turcotte-Pugh(CTP)评分为5分,美国东部肿瘤协作组(ECOG)评分为1分。根据患者MRI特征,巴塞罗那分期(BCLC)评估患者为晚期HCC(IV B期,T4N1M1)。

IMbrave150研究结果显示,阿替利珠单抗联合贝伐珠单抗组 vs 索拉非尼组的12个月总生存期(OS)率为67.2% vs 54.6%,中位无进展生存期(PFS)为6.8个月 vs 4.3个月[2]。
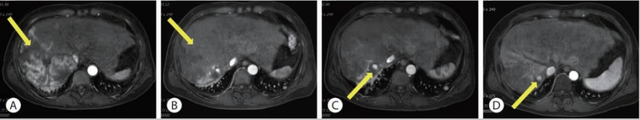
患者根据指南推荐,一线选择阿替利珠单抗+贝伐利珠单抗的联合治疗,每三周给药一次。在治疗的第四周期时,患者肝脏核磁共振成像(MRI)显示一个略增大的累及肝脏右叶的肿块,约22.1cm(图4A)。此外,胸部电子计算机断层扫描(CT)显示,两个肺转移灶的大小较之前均增加,出现了疾病进展(图2B)。
基于SHARP研究[3]以及近期临床研究[4-5]结果提示,晚期HCC患者接受索拉非尼联合放疗(RT)治疗比单独接受索拉非尼治疗有更高的1年生存率,患者二线治疗接受口服索拉非尼(400mg,每日两次),同时对PVTT进行为期12天的RT(25Gy/12 fx)(图5)。
在索拉非尼联合RT治疗2个月后,随访MRI显示患者达部分缓解(PR),AFP和PIVKA-II水平下降。然而,胸部CT扫描显示肺转移灶数量增加。
 图5 随访的肝脏MRI患者三线治疗使用瑞戈非尼(160 mg,每日1次)。接受瑞戈非尼治疗3个月后,随访MRI显示累及肝右叶肿块的动脉强化病灶几乎消失,只有一个结节性动脉强化病灶略有增加(图4C)。然而,肺部转移进展明显,胸部CT扫描显示AFP和PIVKA-II升高(图2D、E,图3)。四线治疗选择双免疫治疗,疗效几近CR!经过讨论决定更换患者治疗方案,6个月后,患者的AFP和PIVKA-II水平恢复正常(图3),肝内肿瘤单个活灶部分略有减少,肺多发转移灶几乎消失(图2F、G,图4D)。您认为四线治疗应该如何选择用药?这一案例又给我们带来什么启示?扫描下方二维码,或点击文末“阅读原文”,查看后续治疗方案!
图5 随访的肝脏MRI患者三线治疗使用瑞戈非尼(160 mg,每日1次)。接受瑞戈非尼治疗3个月后,随访MRI显示累及肝右叶肿块的动脉强化病灶几乎消失,只有一个结节性动脉强化病灶略有增加(图4C)。然而,肺部转移进展明显,胸部CT扫描显示AFP和PIVKA-II升高(图2D、E,图3)。四线治疗选择双免疫治疗,疗效几近CR!经过讨论决定更换患者治疗方案,6个月后,患者的AFP和PIVKA-II水平恢复正常(图3),肝内肿瘤单个活灶部分略有减少,肺多发转移灶几乎消失(图2F、G,图4D)。您认为四线治疗应该如何选择用药?这一案例又给我们带来什么启示?扫描下方二维码,或点击文末“阅读原文”,查看后续治疗方案!参考文献
[1]Villanueva A. Hepatocellular carcinoma. N Engl J Med. 2019;380:1450–1462. [2] Finn RS, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY, et al. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. N Engl J Med. 2020;382:1894–1905. [3] Llovet JM, Ricci S, Mazzaferro V, Hilgard P, Gane E, Blanc JF, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359:378–390.[4] Chu SS, Kuo YH, Liu WS, Wang SC, Ho CH, Chen YC, et al. Effect of radiotherapy on survival in advanced hepatocellular carcinoma patients treated with sorafenib: a nationwide cancer-registrybased study. Sci Rep. 2021;11:1614.[5]Abulimiti M, Li Z, Wang H, Apiziaji P, Abulimiti Y, Tan Y. Combination intensity-modulated radiotherapy and sorafenib improves outcomes in hepatocellular carcinoma with portal vein tumor thrombosis. J Oncol. 2021;2021:9943683.[6]Reig M, Forner A, Rimola J, Ferrer-Fàbrega J, Burrel M, GarciaCriado Á, et al. BCLC strategy for prognosis prediction and treatment recommendation: the 2022 update. J Hepatol. 2022;76:681–693.[7] Wong JSL, Kwok GGW, Tang V, Li BCW, Leung R, Chiu J, et al. Ipilimumab and nivolumab/pembrolizumab in advanced hepatocellular carcinoma refractory to prior immune checkpoint inhibitors. J Immunother Cancer. 2021;9:e001945.[8] Roessler D, Öcal O, Philipp AB, Markwardt D, Munker S, Mayerle J, et al. Ipilimumab and nivolumab in advanced hepatocellular carcinoma after failure of prior immune checkpoint inhibitor-based combination therapies: a multicenter retrospective study. J Cancer Res Clin Oncol. 2022 Jul 21;本文审核:徐蔚然教授
责任编辑:Sheep
*医学界力求其发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。
