1.简介
掌跖脓疱病 (PPP) 是一种影响手掌和/或脚底的慢性、复发性皮肤病。临床上表现为伴有红斑鳞屑的水疱,随后出现无菌脓疱。在西方,由于其表现与脓疱型银屑病的其他亚型相似,因此通常按其局部形式进行分类;然而,可以根据其遗传特征进行区分(与全身性脓疱性银屑病 [GPP] 和 Hallopeau 连续性肢端皮炎相比,白细胞介素 [IL]-36 受体拮抗剂突变的患病率较低)。PPP总体患病率约为 0.05–0.12%;然而,缺乏基于人群的研究。日本PPP患病率约为0.12%,男女比例为0.53。掌跖脓疱病会导致身体残疾,限制手掌和足底的使用,并损害健康相关的生活质量 (HRQOL)。
PPP的病理生理学很复杂且尚未完全了解。IL-23/IL-17 通路(通过 17 型辅助 T 细胞 [Th17] 的增殖)被认为可以刺激细胞因子的产生,并在中性粒细胞浸润和脓疱形成中发挥关键作用。Acrosyringium可能参与PPP中囊泡的形成。由于缺乏标准疗法和疗效,PPP的治疗具有挑战性。日本目前的治疗方法包括局部治疗(维生素 D 3类似物和皮质类固醇)、准分子或紫外线光疗、口服维A酸、甲氨蝶呤和环孢菌素、牙科感染控制或扁桃体切除术以及粒细胞和单核细胞吸附分离术,这些通常会导致治疗效果不佳。生物疗法似乎是一种有效的选择,但需要更多的研究来评估其长期疗效和安全性。
Guselkumab是一种人免疫球蛋白G1λ单克隆抗体,可与IL-23的p19亚基结合,从而阻断IL-23信号通路和随后的细胞因子释放。古塞奇尤单抗的疗效和安全性已在针对中重度斑块状银屑病和银屑病关节炎 (PsA) 患者的全球研究中得到证实,包括 日本 针对中重度斑块状银屑病的研究、GPP 和红皮病型银屑病和PPP。Guselkumab是第一个在美国和欧洲批准用于治疗中重度斑块型银屑病和活动性银屑病关节炎成年患者的 IL-23抑制剂。在日本,它被批准用于治疗斑块型银屑病、GPP和红皮病型银屑病,以及对传统疗法反应不足的PsA患者,并于2018年11月被批准用于PPP。
这项3期研究旨在评估 guselkumab(100 和 200 mg)在日本PPP患者中的疗效和安全性,该药物在第0周、第4周、第12周以及此后每8周 (q8w) 给药一次,直至第60周至第84周。先前发布的数据表明,guselkumab 在 PPP 至第52周期间具有良好的疗效和安全性。本报告描述了 guselkumab 通过W84的疗效和安全性。此外,事后分析通过比较第 60 周时掌跖脓疱病面积和严重指数 (PPPASI)‐75/90 应答者与无应答者之间的患者特征,以及 PPPASI‐75/90 持续疗效之间的患者特征,探讨了与 guselkumab 持续疗效相关的因素。 W84的响应者和非持续响应者。
2.方法
详细的研究方法已于早些时候发表。研究方案得到了所有40个研究中心的机构审查委员会的批准,并且该研究是根据《赫尔辛基宣言》中定义的伦理原则、国际协调委员会(良好临床实践)指南和适用的监管要求进行的。在入组前获得了所有患者的书面知情同意书。
2.1. 患者群体
日本患者(年龄≥20岁)在筛查前至少≥24周被诊断为PPP(伴或不伴脓疱性关节骨炎[PAO]),对常规治疗反应不足,PPPASI总分≥12且筛选和基线时脓疱/水疱的 PPPASI 严重程度评分≥2 被纳入。患有斑块型银屑病、筛选期间 PPPASI 总分改善≥5 或药物诱导的 PPP 的患者被排除。
2.2. 学习规划
这是一项3期、随机、双盲、多中心、安慰剂对照研究,由三个阶段组成:筛选阶段(约 6 周)、盲法治疗阶段(第 0 周至第 60 周)和观察阶段(第 60 周至第 84 周) 。

符合条件的患者被随机分配至三个治疗组之一(比例为 1:1:1):古塞奇尤单抗100mg、古塞奇尤单抗200mg(均在第 0 周、第 4 周、第 12 周以及此后第8周直至第60周)或安慰剂(第 0 周、第 4 周、第 60 周)和W12)作为皮下注射施用。在第 16 周时,安慰剂组的患者被重新随机分配,分别在第 16 周、第 20 周和随后的第 8 周直至第 60 周接受古塞奇尤单抗 100 或 200 mg(1:1 比例)。中央随机化是通过随机排列的块来实现和平衡的。根据基线时 PPPASI 总分(≤20、21-30、≥31)和吸烟状况对患者进行分层。第0周至第60周禁止可能影响PPP进程或研究评估的 PPP治疗(局部保湿剂除外);第60周后对联合治疗的使用没有限制。
2.3. 功效评估
主要、主要次要和探索性疗效终点在之前发表的手稿中进行了描述。第 84 周的其他次要疗效评估包括:(i) PPPASI 总分和掌跖脓疱病严重程度指数 (PPSI) 总分相对于基线的变化;(ii) 随着时间的推移达到以下反应的患者比例:PPPASI-50/75/90/100、PPSI-50/75/90/100、红斑、脓疱/脓疱/ PPSI 子评分为 0(无)或 1(轻微)水疱和脱屑/鳞屑,医生总体评估 (PGA) 评分为明确 (0) 或最低 (1),PGA 评分为 0/1,改善≥2 级(评分范围 0 [明确] 至 5 [非常严重] ]) 从基线开始;(iii) 患者报告的结果 (PRO) 1 :36 项简短健康调查 (SF-36) 评分中相对于基线的变化,包括身体成分摘要 (PCS) 和心理成分摘要 (MCS),37 EuroQoL-5 维度 (EQ-5D) 问卷评分,和皮肤科生活质量指数 (DLQI) 评分。
第60周时PPPASI-75/90应答者和无应答者之间的患者特征(人口统计学、疾病特征、吸烟、病史以及既往和合并用药)、SF-36、EQ-5D 和 DLQI评分的事后比较,并在第84周对 PPPASI-75/90 持续和非持续反应者进行了评估。
2.4. 安全评估
治疗中出现的不良事件(TEAE)、实验室参数、生命体征、体格检查、心电图(ECG)、注射部位反应、过敏反应、感染、主要不良心血管事件(MACE)、恶性肿瘤、过敏反应或血清病样反应和结核病审查从签署知情同意书到 W84 进行评估。从第72周到第84周,仅收集被认为与研究治疗相关的 TEAE。
2.5. 统计分析
2.5.1. 样本量和分析集
先前发表的手稿中描述了样本大小的基本原理。“至第84周”的预先计划总结和分析基于第0周或第16周随机接受古塞奇尤单抗的患者。事后分析基于第 84 周完成研究的一部分患者。安全性分析包括接受≥1次研究治疗注射的患者。
2.5.2. 统计评估
之前的出版物中描述了第16周的功效分析。通过 W84 使用描述性统计分析 PPPASI、PPSI、PGA、SF-36、EQ-5D 和 DLQI。
通过比较第60周PPPASI-75/90应答者和无应答者之间以及第84周 PPPASI-75/90 持续应答者和非持续应答者之间的患者特征,描述性地进行了事后分析。第84周时 PPPASI-75/90 持续缓解者定义为在第 60 周和第 84 周均达到PPPASI-75/90缓解的患者。第84周时 PPPASI-75/90 非持续应答者定义为在第60周但未在第84周达到 PPPASI-75/90 应答的患者。来自古塞奇尤单抗联合组的数据作为单个总体古塞奇尤单抗组的结果呈现。该事后分析基于观察到的数据,并且没有进行缺失数据插补。事后结果的统计测试被认为是名义上的,手稿中未显示统计值。对安全性数据进行了描述性总结。治疗组使用监管活动医学词典(19.1 版)系统器官类别和首选术语总结 TEAE。
3. 结果
3.1. 患者性格
该研究于2015年12月15日至2018年7月17日进行。总体而言,159名患者在第0周被随机分配,133名患者在第84周完成研究(45、43、21和24名患者接受古塞奇尤单抗100mg、古塞奇尤单抗200mg、安慰剂组)分别为→古塞奇尤单抗100mg组和安慰剂→古塞奇尤单抗200mg组)。截至第60周,25/159名患者 (15.7%) 停止了研究治疗,最常见的原因是 TEAE。在第60周至第84周期间,古塞奇尤单抗200mg组的一名患者退出了研究(图)。

3.2. 功效
3.2.1. PPPASI 和 PPSI
在第60周期间观察到PPPASI和PPSI总分的持续改善,并在所有治疗组(包括安慰剂交叉组)的观察阶段(第 60 周至第 84 周)持续改善(图(图33和图 S1)。在第84周时,古塞奇尤单抗100mg的PPPASI和PPSI总分平均改善百分比分别为77.53%、85.13%、75.98%和74.28%,以及 58.9%、74.2%、68.9% 和 63.0%。古塞奇尤单抗200mg、安慰剂→古塞奇尤单抗 100 mg 和安慰剂→古塞奇尤单抗200mg组(表)。


PPPASI-50应答者的比例在第60周期间有所增加(表2)并增加/持续到第84周,对于古塞库单抗100 mg、古塞库单抗200 mg、安慰剂→古塞库单抗100 mg和安慰剂→古塞库单抗200 mg分别达到最大值88.9%、95.3%、85.7%和87.5%组。第84周时,古塞奇尤单抗 200 mg 组 (81.4%) 中 PPPASI-75 应答者的比例在数值上高于古塞奇尤单抗 100 mg (68.9%)、安慰剂→古塞奇尤单抗 200 mg (66.7%) 和安慰剂→古塞奇尤单抗 100 mg( 61.9%)群体。PPPASI-90/100 反应者也观察到类似的趋势。

PPSI-50 应答者的比例在第60周期间有所增加(表2)并持续至第 84 周(古塞奇尤单抗100mg、古塞奇尤单抗 200 mg、安慰剂→古塞奇尤单抗 100 mg 组和安慰剂→古塞奇尤单抗 200 mg 组分别为 66.7%、83.7%、81.0% 和 79.2%)。第84周时,对于PPSI-75(62.8% vs 33.3%)和PPSI-90(32.6% vs 17.8%),古塞奇尤单抗200 mg组中的应答者比例在数值上高于古塞奇尤单抗100 mg组(32.6% vs 17.8%),而PPSI的比例‐75/90 的应答者在安慰剂 → guselkumab 100 mg 和 200 mg 组中具有可比性。PPSI-100应答者也观察到类似的趋势。在第60周观察到红斑、脓疱/水疱和脱屑/鳞屑的PPSI子评分有所改善,并持续到第84周。
3.2.2. PGA
在第 60 周期间,达到 PGA 分数 0/1 的患者比例有所增加(表2),以及古塞奇尤单抗治疗组从第 60 周到第 84 周(表1)。在古塞奇尤单抗 100 mg、古塞奇尤单抗 200 mg、安慰剂→古塞奇尤单抗 100 mg 组中,第 84 周 PGA 评分达到 0/1 且较基线改善≥2 级的患者比例分别为 37.8%、53.5%、42.9% 和 54.2%和安慰剂→guselkumab 200 mg 组,分别。
3.2.3. 患者报告的结果
从基线到第 84 周,所有治疗组的 SF-36(PCS 和 MCS)、EQ-5D(视觉模拟量表 [VAS] 和指数)和 DLQI 评分均观察到改善(表3)。

SF-36 分数的事后评估
与第 60 周无反应者相比,第 52 周/第 72 周/第 84 周时 PPPASI-75/90 应答者的 SF-36(PCS 和 MCS)评分相对于基线的平均增加(表明改善)在数值上更高(表4)。与第 84 周的非持续应答者相比,在 PPPASI-75/90 持续应答者中观察到了类似的趋势,除了 PPPASI-75/90 非持续应答者在第 72 周时 SF-36 MCS 评分相对于基线的增加在数值上更高与第 84 周持续缓解者相比(表5)。

EQ-5D 分数的事后评估
与第60周无反应者相比,第52周/第72周/第84周时 PPPASI-75/90 应答者的 EQ-5D 评分(指数和 VAS)评分(表明改善)相对于基线的平均增加在数值上更高(表4)。与第84周的非持续应答者相比,在 PPPASI-75/90 持续应答者中观察到了类似的趋势,除了第52周和第72周 EQ-5D VAS 评分相对于基线的增加分别在PPPASI-90和第72周中更高。 PPPASI-75 非持续反应者与第84周持续反应者相比(表5)。
DLQI 分数的事后评估
与第60周无反应者相比,PPPASI-75/90反应者在第52周/第72周/第84 周时 DLQI 评分相对于基线的平均下降(即 DLQI 改善)在数值上更高(表(表4)。与第84周的非持续反应者相比,在 PPPASI-75 持续反应者中观察到类似的趋势。与第84周的持续缓解者相比,PPPASI-90 非持续缓解者在第52周/第72周/第84周的 DLQI 评分较基线的改善在数值上更高(表(表5)。与第60周的无反应者相比,PPPASI-75/90 反应者中第 52 周/第 72 周/第84周 DLQI 评分达到 0/1(对患者的生活没有/几乎没有影响)的患者数量较高。与第84周的非持续反应者相比,PPPASI-75/90 持续反应者中观察到类似的趋势。
3.2.4. 患者特征的事后评估
详细的事后评估总结于表中表6和和7。
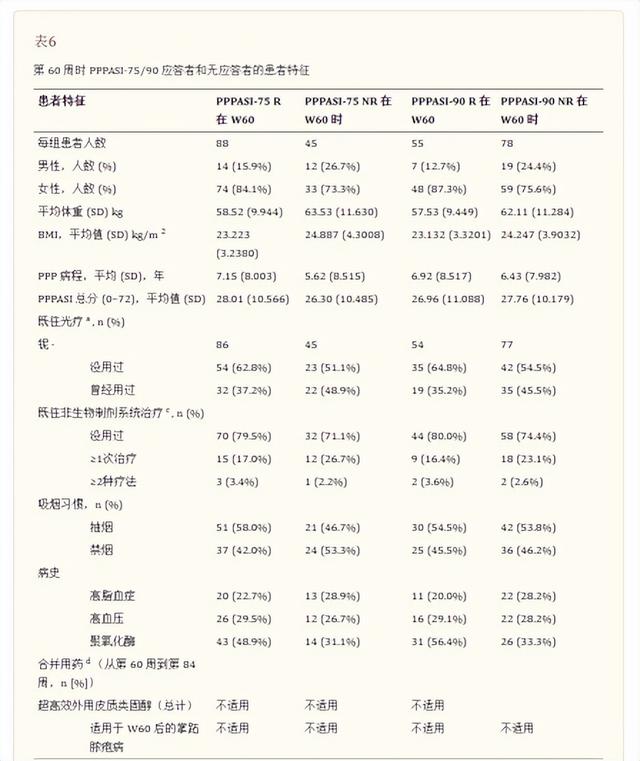

人口统计和疾病特征
从数字上看,性别对第60周应答者第84周PPPASI-75/90应答的维持没有影响。PPPASI-75/90应答者在第60周时的平均基线体重和体重指数 (BMI) 略低于无应答者。基线 PPP 疾病持续时间没有观察到一致的趋势。在第60周的PPPASI-75/90应答者和无应答者之间或在第84周的 PPPASI-75/90 持续和非持续应答者之间,基线PPPASI总分没有观察到显着差异。
病史
大多数患者有PAO病史(>31.0%)、高血压病史(>21.0%)和高脂血症病史(>10.0%)。第 60 周时,PPPASI-75/90 应答者和无应答者之间患有高脂血症和高血压的患者比例相当;PPPASI-75应答者(48.9% vs 31.1%)和 PPPASI-90 应答者(56.4% vs 33.3%)中 PAO 患者的比例在数值上高于无应答者。在第84周比较PPPASI-75/90持续和非持续反应者时,没有观察到有这些病史的患者比例的一致趋势。
先前和伴随药物
与第60周时无反应者相比,PPPASI-75反应者中既往接受过光疗(37.2% vs 48.9%)和非生物全身治疗(17.0% vs 26.7%)的患者比例较低。在接受过光疗(35.2% vs 45.5%)和非生物全身治疗(16.4% vs 23.1%)的患者中,PPPASI-90 也观察到类似的趋势。与第84周的非持续反应者相比,PPPASI-75/90 持续反应者中既往接受过非生物全身治疗的患者比例相对较低。从第60周到第84周,同时使用超高效外用皮质类固醇治疗PPP时,没有观察到一致的趋势。
吸烟史
PPPASI-75应答者中吸烟者的比例在数值上高于无应答者(58.0% vs 46.7%),但在第60周时PPPASI-90应答者中没有观察到明显趋势。第 84 周时,PPPASI-75/90持续应答者中吸烟者的比例相对低于非持续应答者。
3.3. 安全
表中列出了TEAE到W84的总体总结表8。W84期间没有死亡报告。古塞奇尤单抗 100 mg、古塞奇尤单抗200mg组中 TEAE ≥1 例的患者比例分别为 88.9% (48/54)、100.0% (52/52)、92.0% (23/25) 和 84.6% (22/26)分别为安慰剂→古塞奇尤单抗 100 mg 组和安慰剂→古塞奇尤单抗 200 mg 组。在古塞奇尤单抗联合治疗组中,大多数 TEAE 为轻度(61.8%)或中度(26.8%),鼻咽炎是最常见的 TEAE(48.4% [76/157] 患者)。严重的 TEAE 并不常见(7.6% [12/157] 的患者);古塞奇尤单抗 100 mg、古塞奇尤单抗 200 mg、安慰剂→古塞奇尤单抗 100 mg 组和安慰剂→古塞奇尤单抗 200 mg 组中分别有 5.6%、9.6%、12.0% 和 3.8% 的患者。

到第72周(最后一次研究治疗剂量后 12 周或约 5 个半衰期),古塞奇尤单抗治疗中被认为与研究治疗合理相关的 TEAE 患者比例分别为 35.2%、42.3%、28.0% 和 34.6%分别为 100 mg、guselkumab 200 mg、安慰剂→guselkumab 100 mg 组和安慰剂→guselkumab 200 mg 组。古塞奇尤单抗 100 mg、古塞奇尤单抗 200 mg、安慰剂→古塞奇尤单抗 100 mg 组和安慰剂→古塞奇尤单抗 200 mg 组中,导致研究治疗终止的 TEAE 发生率分别为 13.0%、11.5%、4.0% 和 3.8% 。
从第 72 周到第 84 周,没有 TEAE 与研究治疗合理相关。所有治疗组中治疗引起的感染的发生率相似。在接受 200 mg 古塞奇尤单抗治疗的患者中,仅 3.8% (2/52) 报告出现严重的治疗突发感染。最常报告的注射部位反应是注射部位红斑和注射部位瘙痒,与安慰剂→古塞奇单抗 100 mg 组相比,安慰剂→古塞奇尤单抗 200 mg 组(23.1%)和古塞奇尤单抗 200 mg 组(25%)发生率较高( 16%)和古塞奇尤单抗 100 mg 组(9.3%)。没有患者出现过敏反应、血清病样反应、MACE 或活动性结核病。安慰剂→古塞奇尤单抗 100 mg 组报告了 1 例严重的胃癌 TEAE。
生命体征和心电图的变化没有临床意义。没有实验室异常被报告为严重 TEAE 或导致研究治疗中断。
4.讨论
缺乏古塞奇尤单抗治疗PPP一年以上的疗效和安全性证据。本研究证明了 guselkumab 在84周内治疗PPP的有效性和安全性。早在第16周就观察到疗效,持续到第60周(治疗阶段),并持续到第84周(观察阶段)。
在古塞奇尤单抗联合治疗组中,第 84 周时 PPPASI 和 PPSI 总分相对于基线的平均改善百分比分别为约 79% 和约 66%。古塞奇尤单抗 100 和 200 mg 组之间 PPPASI 总分较基线的平均改善百分比相当,而在第 60、72 和 84 周时,与古塞奇尤单抗 100 mg 组相比,古塞奇尤单抗 200 mg 组的 PPSI 总分在数值上有更高的改善。这种差异可能归因于 PPPASI 和 PPSI 回答之间的分数计算方式不同;PPPASI 评估包括 PPSI 评估中未包含的 PPP“领域”。安慰剂交叉组的PPSI总分没有发现这种趋势。
与安慰剂组相比,第16周时古塞奇尤单抗200mg组患者的 PPPASI-50 反应没有表现出统计学上的显着差异(p=0.78),而古塞奇尤单抗 100 mg组患者出现PPPASI-50的比例显着更高响应者(p=0.02)。 1 第 24周后,使用200 mg古塞奇尤单抗观察到了更高的改善,并且在第 60 周和第84周时使用100 mg古塞奇尤单抗观察到了相当的 PPPASI-50 缓解率,这抵消了早期评估点相对较低的疗效。第60周时的 PPPASI-75/90/100 反应率也出现了类似的趋势。古塞奇尤单抗治疗组的PGA评分在第60周(治疗阶段)和第60周至第84周(观察阶段)持续改善。
所有PRO通过W84都有所提高,与 PPPASI、PPSI 和 PGA 分数的提高一致。事后分析显示,与无反应者和非反应者相比,第 60 周 PPPASI-75/90 反应者和第84周持续反应者的 SF-36(PCS 和 MCS)和 EQ-5D(指数和 VAS)评分有所改善。持续反应者分别表明健康状况较好。在第 84 周,所有治疗组的 HRQOL(通过 DLQI 评估)均有所改善。事后分析表明,与无反应者和非持续反应者相比,第60周的PPPASI-75反应者和第 84 周的持续反应者分别实现了更大的HRQOL改善(通过DLQI评估)。由于DLQI在临床上与PPPASI相关,因此PPPASI持续反应者往往会获得更好的DLQI反应。
根据事后分析,高脂血症、高血压和 PAO 是常见的合并症,与之前的研究一致; 7 , 40 然而,这些疾病并不影响W84的疗效反应。第 60 周时 PPPASI-75/90 应答者的体重和 BMI 往往较低;与无反应者相比,接受过光疗和非生物全身治疗的患者比例较低。进行统计检验以测量第 60 周 PPPASI-75/90 应答者和无应答者之间的关联强度或第 84 周 PPPASI-75/90 持续应答者和非持续应答者之间的关联强度以及每个患者的特征。体重/BMI 和 PAO(是/否)成为具有统计显着性的因素,与双盲安慰剂对照期(截至第 16 周)结果中观察到的结果一致。然而,由于事后分析的性质和患者数量有限,统计值被认为是名义值,因此未在手稿中显示。古塞奇尤单抗在非吸烟者和既往未接受过非生物系统治疗的患者中展示了疗效可持续性的数字趋势。
截至 W84 观察到的安全性与之前针对 PPP 以及其他疾病(包括中重度斑块型银屑病和 PsA)的 guselkumab 临床方案一致。总体而言,guselkumab(100 和 200 mg)耐受性良好,在第84周期间,guselkumab 剂量之间的安全性没有明显差异 。
4.1. 局限性
由于安慰剂组的患者在第 16 周时被重新随机分配接受古塞奇尤单抗治疗,因此第 16 周后没有进行安慰剂对照比较。第 60 周后,对伴随药物的使用没有限制,这使得很难确定古塞奇尤单抗的真实缓解率。事后分析包括相对较小的样本量。
4.2. 结论
古塞奇尤单抗在第60周期间对PPP的治疗有效,并且疗效一直持续到第84周。古塞奇尤单抗还改善了HRQOL。总体而言,日本患者的W84试验证明了古塞奇尤单抗在PPP中具有良好的获益风险比。
