
胶质瘤的治疗
我国脑胶质瘤的年发病率为5/10万~8/10万,5年病死率在全身肿瘤中仅次于胰腺癌和肺癌。脑胶质瘤的发病机制尚不明了,目前确定的两个危险因素是:暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。世界卫生组织(WHO)的中枢神经系统(CNS)肿瘤分类(2021)根据IDH状态将成人型弥漫性神经胶质瘤分为:IDH突变型星形细胞瘤,少突神经胶质瘤IDH突变和1p/19q共缺失,以及胶质母细胞瘤IDH野生型。在原发性恶性中枢神经系统(central nervous system,CNS)肿瘤中,胶质母细胞瘤(glioblastoma,GBM,WHO IV级)的发病率最高,占46.6%。IDH突变的胶质瘤显示出独特的代谢模式——最明显的是糖酵解显著减少,这是快速增殖的恶性肿瘤的代谢标志。IDH突变的神经胶质瘤中独特的代谢途径不仅解释了这种疾病的性质,而且表明针对IDH突变特异性代谢模式开发靶向策略可能是神经胶质瘤治疗的一种有价值的方法[1]。NCCN指南已推荐伴有IDH突变型的胶质瘤患者使用Ivosidenib进行治疗。除此之外针对多个标志物的药物试验正在进行中[2]。
Vorasidenib在IDH1/2突变的低级别胶质瘤中的疗效
Vorasidenib是一种抑制IDH1/2突变的口服制剂,可穿透血脑屏障。INDIGO是一项双盲、3期临床试验,共纳入331名仅接受手术治疗的、肿瘤残留或复发的2级IDH突变的胶质瘤患者。其中168名患者被分配到Vorasidenib组,163名患者被分配到安慰剂组,主要终点为基于成像的无进展生存期,次要终点为二次肿瘤干预时间。安慰剂组的患者在成像基础上确认疾病进展后,有资格交叉到Vorasidenib治疗组。星形胶质细胞瘤和少突胶质细胞瘤患者在两组中分布相似。

无进展生存期及二次干预时间[3]
在平均14.2个月的随访中,226名患者(68.3%)继续接受Vorasidenib或安慰剂治疗。与安慰剂组相比,Vorasidenib组的无进展生存期显著提高(中位无进展生存期27.7个月VS 11.1个月)。与安慰剂组相比,Vorasidenib组下一次干预的时间显著缩短。这项3期临床试验取得了令人欣喜的结果,Vrasidenib可将IDH 1/2突变的2级胶质瘤患者的无进展生存期提高一倍以上,这种疗法的研发为低级别胶质瘤的治疗带来新的突破,为更多低级别胶质瘤患者带来希望。同时,值得一提的是,Vrasidenib已被FDA授予快速通道资格,或许会成为低级别胶质瘤的首个靶向治疗药物。美国芝加哥西北大学范伯格医学院神经病学副教授、神经肿瘤专家Rimas V. Lukas博士回顾了自己此前在2023年ASCO年会上介绍的III期INDIGO试验(NCT04164901)的要点,根据试验结果强调,在IDH1/2突变胶质瘤的治疗方案中添加Vorasidenib(AG-881)是可行的新型靶向疗法。
ONC201在H3K27M突变弥漫性中线胶质瘤中的临床疗效
H3K27M突变弥漫性中线胶质瘤(DMG)患者尚无有效疗法。ONC201最近在这些患者中显示出疗效。小分子ONC201是一种多巴胺受体D2(dr D2)拮抗剂,通过破坏整合的代谢和表观遗传途径并逆转H3K27me3的病理性减少来发挥其在H3K27M-DMG中的疗效。ONC 201-014(NCT 03416530)实验纳入30名患者,ONC 201-018(NCT 03134131)实验纳入41名患者。尽管两项试验的总生存期有所不同,但两者的中位总生存期无统计学差异,在ONC201-014中为21.7个月(n= 24)和ONC201-018的13.9个月,中位PFS无统计学差异,ONC201-014中的中位PFS为9.4个月(n= 24)和ONC201-018的4.8个月

接受ONC201治疗的H3K27M-DMG试验患者的生存结果[4]
与历史队列进行了探索性比较。(历史对照数据来自先前发表的的新诊断H3K27M突变DMG病例的荟萃分析和复发性H3K27M突变DMG患者的生存数据)。在多变量Cox分析中调整潜在混杂因素后,ONC201治疗仍然具有显著性。生存分析比较了接受ONC201治疗的非复发性DMG患者与公布的未经处理的H3K27M-DMG历史对照显示出OS显著增加(ONC201治疗组自诊断起的中位OS为21.7个月,而历史对照组为12个月,接受ONC201治疗的复发性DMG患者的中位OS为9.3个月,而历史对照组为8.1个月。
此项研究综合临床、影像学和分子分析证明了ONC201在H3K27M-DMG的疗效,并支持ONC201作为第一种单药疗法,通过同时抑制关键的能量产生代谢途径和逆转h3k 27m 3的病理性减少来改善H3K27M-DMG的疗效。目前正在通过一项组合II期试验(NCT05009992)、一项安慰剂对照III期试验(NCT05580562)以及其他可能改善中枢神经系统渗透和/或治疗效果的ONC201相关化合物(ONC206和ONC212)对DMG患者进行进一步研究。
PTPRZ1-MET融合:一项多中心、随机、开放性II/III期试验
PTPRZ1-MET融合与胶质瘤从低级到高级的进展有关,这是MET抑制剂vebreltinib的靶点[3]。这项多中心、随机、开放标签、对照试验旨在评估vebreltinib治疗携带ZM融合基因的sGBM/IDH突变胶质母细胞瘤患者的安全性和有效性。共招募84名携带ZM融合基因的sGBM或IDH突变胶质母细胞瘤患者。以1:1的比例随机分配至vebreltinib和对照组(替莫唑胺或顺铂联合依托泊苷)。主要终点是总生存期(OS)。次要终点是无进展生存期(PFS)和客观缓解率(ORR)。2023年3月患者招募结束。

研究流程[5]
II型RAF抑制剂tovorafenib
FIREFLY-1是一项开放标签II期研究。该试验结果显示:在69名携带BRAF突变的复发或进展性低级别胶质瘤儿童患者中,Tovorafenib单药治疗使得67%的患者肿瘤缩小,其中17%的患者肿瘤完全消失。除此之外,还有26%的患者疾病稳定因此总的临床获益率为93%。疗效平均持续时长为16.6个月。这些数据表明,Tovorafenib可能是对BRAF突变的复发或进展性低级别胶质瘤儿童患的一种有效的药物。
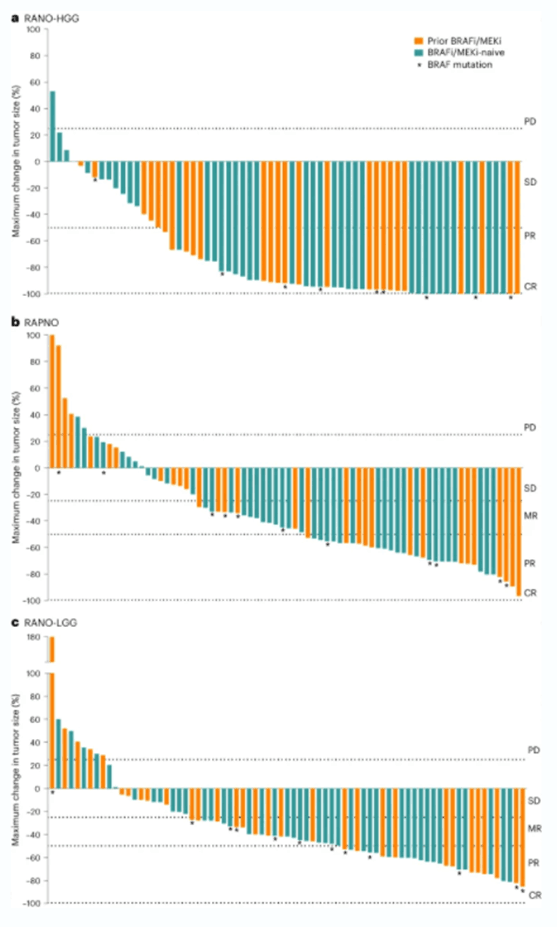
可评估患者肿瘤大小的最大变化[6]
面临的挑战
脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤。脑胶质瘤治疗以手术切除为主,结合放疗、化疗等综合治疗方法。相较其他肿瘤,脑胶质瘤靶向治疗发展缓慢,目前尚无专属获批的靶向药物,指南中也以NTRK等泛癌种靶点为推荐。但是分子标志物已经在胶质瘤的辅助诊断和分级中发挥了重要作用,其靶向药物的相关研究也从未停止。胶质瘤作为一种颅内肿瘤有其特殊性,但是未来随着相关研究的不断深入,相信胶质瘤患者很快会迎来其专属靶向药物,对胶质瘤患者的治疗方案带来新的变革。
参考文献
1.脑胶质瘤诊疗指南(2022版)
2.Central Nervous System Cancers 2023.v1
3.Br J Cancer. 2020 May;122(11):1580-1589.
4.Cancer Discov. 2023 Nov 1;13(11):2370-2393.
5.Chin Neurosurg J. 2023 Jul 14;9(1):21.
6.Nat Med. 2024 Jan;30(1):207-217.
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!
