
对于激素受体阳性(HR+)乳腺癌,内分泌治疗是一种主要的治疗方法。尽管该疗法能显著改善患者的预后,但仍有部分患者在辅助性内分泌治疗后出现耐药现象。先前的文章中,我们探讨了ESR1基因突变作为内分泌治疗耐药的关键因素(详见《揭秘ESR1基因突变:乳腺癌内分泌治疗耐药的关键因素》),并了解了内分泌治疗耐药的基本机理。这类耐药现象可归因于基因组变异和表观遗传学变异。今天,我们将深入探讨其中一条导致内分泌治疗耐药的路径——PAM信号通路。
PAM信号通路激活机理PAM信号通路由PI3K-AKT-mTOR组成。当激素、生长因子、细胞因子等配体与受体酪氨酸激酶(RTK)结合后,PI3K被激活,进而将磷脂酰肌醇-4,5-二磷酸转化为磷脂酰肌醇-3,4,5-三磷酸(PIP3)。活化的PIP3可与磷酸肌醇依赖性激酶-1(PDK1)结合,促使AKT的Thr308位点磷酸化;在mTOR复合体2(mTORC2)作用下,AKT的Ser473位点也被磷酸化,进而完全激活AKT。活化的AKT可通过抑制结节性硬化症复合物亚基1/2(TSC1/2)的活性激活mTOR复合体1(mTORC1),从而正向调控细胞增殖。PTEN则通过对PIP3去磷酸化为PIP2,负调控PI3K/AKT信号通路(图1)[1]。

图1 PAM信号通路
PAM信号通路异常激活综上所述,PAM信号通路主要受到PIK3CA、AKT和PTEN等基因调控。这些基因的突变会导致该信号通路异常激活,促进乳腺癌的发生发展,并与内分泌治疗耐药密切相关。研究表明,PIK3CA基因突变是最常见的类型,突变频率大约为45%,其次是PTEN基因(7.5%)和AKT基因(7%)[2、3]。
PIK3CA基因突变位点众多,70%~80%的突变发生在第9号外显子E545K、E542K和第20号外显子H1047R位点,其它突变频率较低的位点包括第4号外显子N345K突变、第13号外显子E726K突变、第20号外显子G1049R突变、第9号外显子Q546K、Q546R、E545A、E545G突变以及第7号外显子C420R突变等(图2)[4]。
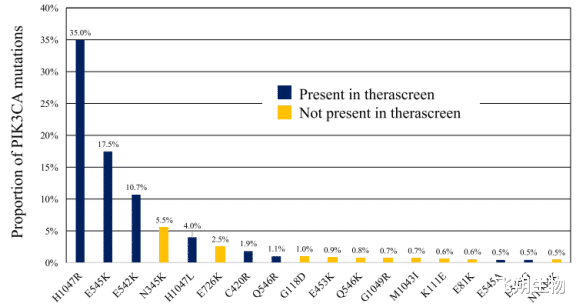
图2 PIK3CA基因在乳腺癌中的突变类型
PTEN基因一种重要的抑癌基因,其编码的蛋白质在调节细胞生长、增殖、DNA修复和细胞运动方面发挥重要作用。PTEN基因与遗传性乳腺癌有关,研究表明:PTEN基因的胚系突变是导致Cowden综合征的主要原因,携带这种突变的女性终生患乳腺癌的风险为40%~60%,且大多数患者在38~50岁罹患肿瘤[5、6]。AKT基因家族包含三种亚型:AKT1、AKT2、AKT3,它们位于PAM信号通路下游,是该通路的主要靶标之一。在这三个亚型中,AKT1突变最为常见[7]。
异常激活的PAM信号通路能够直接磷酸化雌激素受体(ER)的特定位置(如Ser167),使得即使在雌激素缺乏的情况下也能激活ER,促进肿瘤细胞适应低雌激素环境,导致对内分泌治疗失去敏感性。此外,磷酸化的ER还能上调RTK蛋白表达,形成正反馈进一步激活PAM通路,加速肿瘤细胞增殖(图3)[8]。
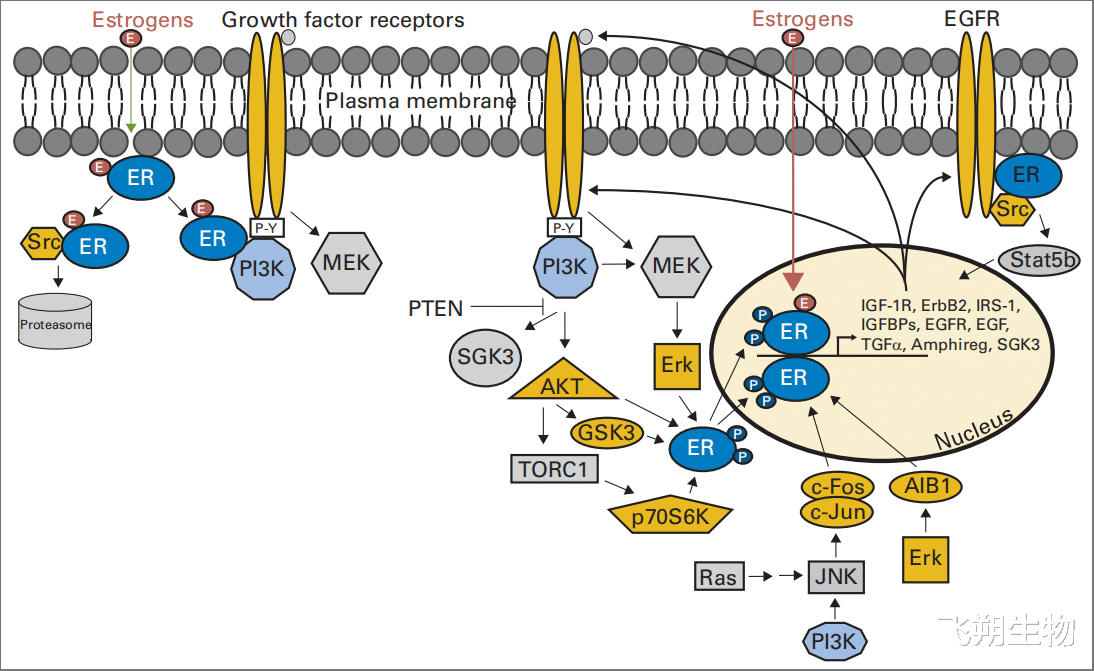
图3 雌激素受体与PAM信号通路的相互作用
PAM信号通路抑制剂根据PAM信号通路的关键分子,PAM信号通路抑制剂主要可分为PI3K抑制剂、AKT抑制剂和mTOR抑制剂,这些抑制剂通过靶向PAM信号通路中的不同节点来阻断信号的传递,从而抑制肿瘤细胞的增殖和存活。目前,针对HR+/HER2-乳腺癌患者,已有多种靶向PAM信号通路抑制剂在国内外获批上市,为临床治疗提供了新的选择和希望。
PI3K抑制剂
Alpelisib是首个获批乳腺癌适应证的PI3K抑制剂。2019年5月24日,FDA批准了Alpelisib与fulvestrant联合治疗既往接受过内分泌治疗进展的HR+/HER2-/PIK3CA基因突变的绝经后晚期或转移性乳腺癌患者。此次获批是基于SOLAR-1研究(NCT02437318)数据:PIK3CA基因突变亚组中,Alpelisib联合fulvestrant的中位PFS显著延长(11.0个月 vs 5.7个月,HR=0.65,P<0.001)(图4)[9]。国内目前暂未获批。
Inavolisib是国内首个获批乳腺癌适应症的PI3K抑制剂,2025年3月11日,MNPA批准了Inavolisib+Palbociclib+Fulvestrant联合治疗内分泌耐药/PIK3CA突变/HR+/HER2-/局部晚期或转移性乳腺癌患者。而在2024年10月10日,FDA也批准了该适应症。此次获批是基于INAVO120研究(NCT04191499)数据:含Inavolisib的三药联合方案在PFS上有显著获益(15.0个月 vs 7.3个月,HR=0.43,P<0.0001)(图5)[10]。
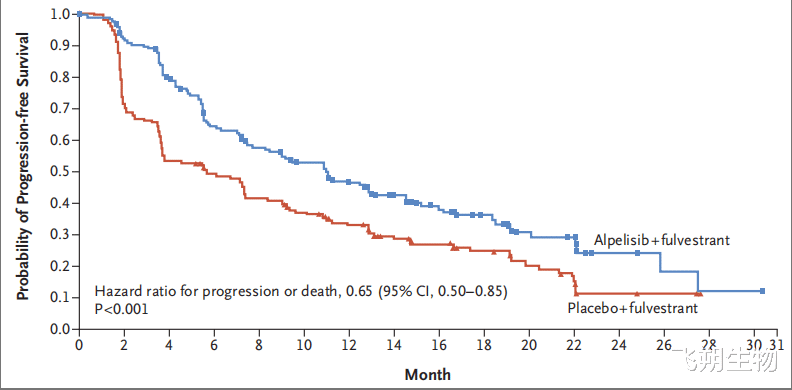
图4 SOLAR-1研究
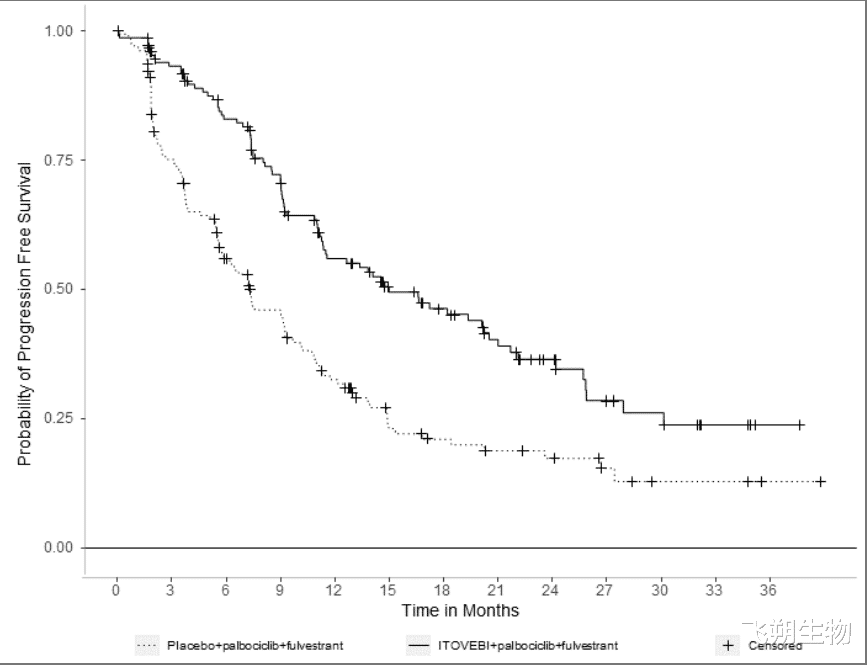
图5 INAVO120研究
AKT抑制剂
2023年11月16日,FDA批准Capivasertib+fulvestrant联合治疗HR+/HER2-/局部晚期或转移性乳腺癌伴PIK3CA/AKT1/PTEN一个或多个基因变异的乳腺癌患者。此次获批是基于CAPItello-291研究(NCT04305496)数据:在PIK3CA/AKT1/PTEN基因变异人群中,Capivasertib联合fulvestrant的中位PFS显著延长(7.3个月 vs 3.1个月,HR=0.50,P<0.001)(图6)[11]。国内目前暂未获批。

图6 CAPItello-291研究
mTOR抑制剂
Everolimus是首个获批乳腺癌适应证的mTOR抑制剂。2012年7月20日,FDA批准了Everolimus联合exemestane用于治疗既往来曲唑或阿那曲唑治疗失败后的HR+/HER2-/绝经后晚期女性乳腺癌患者。此次获批是基于BOLERO-2研究(NCT00863655)数据:Everolimus联合exemestane的中位PFS显著延长(6.8个月 vs 2.8个月,HR=0.43,P<0.001)(图7)[12]。2022年02月11日,NMPA也批准了该适应症。

图7 BOLERO-2研究
小结PAM信号通路是乳腺癌中常见的激活通路之一,也是多种内科治疗手段耐药的主要机制。除了上述提到的内分泌治疗耐药外,PAM信号通路还与化疗耐药、CDK4/6抑制剂耐药和抗HER2治疗耐药密切相关。对于HR+/HER2-乳腺癌患者而言,在初次诊断为晚期乳腺癌或疾病进展时或进展后,进行PAM信号通路相关基因(PIK3CA、AKT1、PTEN等)的检测,有利于更早地从精准靶向治疗中获益。目前,众多针对PAM信号通路的抑制剂正处于研究阶段,期待未来有更多的患者能获得更好的治疗效果[13、14]。
参考文献
The Lancet Oncology,2024,25(4):e139-e151.
Journal of Cancer,2021,12(14):4408-4417.
Nat Cancer,2024,5(4):673-690.
Breast cancer research,2020,22:1-9.
Cancer treatment reviews,2010,36(8):577-583.
WB Saunders,2007,34(5):428-434.
Nature,2019,569(7757):560-564.
Journal of clinical oncology,2011,29(33):4452-4461.
N Engl J Med 2019,380:1929-40.
FDA-Inavolisib说明书
FDA-Capivasertib说明书
New England Journal of Medicine,2012,366(6):520-529.
PI3K/AKT/mTOR信号通路抑制剂治疗乳腺癌临床应用专家共识
NCCN Invasive Breast Cancer Guidelines Version 1.2025
