*仅供医学专业人士阅读参考

胃癌靶向治疗+免疫治疗+化疗,多线多周期治疗导致血小板减少,如何管理?
胃癌是一种常见的恶性肿瘤,发病率位列我国恶性肿瘤发病率的第4位,死亡率的第3位[1]。对于晚期转移性胃癌,目前公认应采取系统性治疗为主的综合治疗。在我国,针对胃癌的系统性治疗药物主要包括化疗药物、分子靶向药物以及免疫检查点抑制剂,这些抗肿瘤治疗手段在改善患者预后的同时,也可导致较严重的肿瘤治疗相关不良反应,如血小板减少症。因此,在整个抗肿瘤治疗过程中,不良反应的控制需贯穿胃癌治疗的始终。其中,肿瘤治疗所致血小板减少症(CTIT)的控制有助于提高患者的治疗效果和生活质量。
对于胃癌治疗所致血小板减少症,临床应如何进行管理?本期我们将带来中国科学技术大学附属第一医院韦婕医师分享的1例晚期转移性胃癌多线治疗期间反复出现血小板减少症的治疗过程,并邀请中国科学技术大学附属第一医院王刚教授对该病例诊疗过程进行精彩点评,为胃癌CTIT患者的升板治疗提供宝贵经验。
病例分享者简介
韦婕 医师
中国科学技术大学附属第一医院 主治医师
安徽医科大学 肿瘤学硕士
参加多项临床研究工作
参与发表医学论文多篇
安徽省抗癌协会肿瘤支持治疗专业委员会委员
一般资料基本情况
患者男,66岁,2021年8月因“胃癌术后近1月余”入院。
现病史

既往史
否认高血压、糖尿病、心脏病等;2021年7月胃手术病史。
个人史、家族史无特殊
查体
ECOG 1分,NRS 0分。
辅助检查影像学检查
胸腹部CT检查结果(2021.07.30)。(图1)
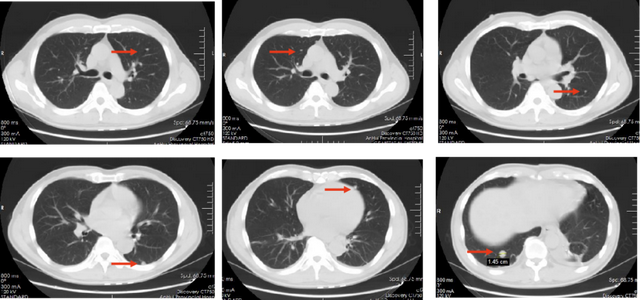

图1 胸部(上)和腹部(下)CT检查
实验室及其他检查
肝功能检查显示Child-Pugh B级(7分)
肝性脑病:无 1分
腹水:轻度 2分
总胆红素:47µmol/L 2分
白蛋白:44g/L 1分
凝血酶原: 14.5s 1分
手术病理:贲门中低分化腺癌,并见微乳头状癌成分约占10%(SiewertⅢ型),溃疡型,浸润胃壁全层并浸透浆膜,肌间神经束见癌累及(+),间质见广泛癌栓。上切缘见癌累及,大网膜及下切缘未见癌累及;淋巴结共(28/29枚)见癌转移;肝结节见癌转移。
免疫组化:HER2(3+);Ki-67(80%+);PD-L1 综合阳性评分(CPS)8分。
二代测序(NGS):HER2扩增。
诊断胃癌伴肝、肺、淋巴结转移姑息术后(pT4aN3bM1 HER2扩增 CPS 8分)
肝功能不全(Child-Pugh B级)
治疗经过1、患者抗肿瘤治疗过程
01
2021.08.03-2022.06.28
胃多发转移姑息术后,予以“帕博利珠单抗+曲妥珠单抗+奥沙利铂+卡培他滨*每3周一次(q3w)”治疗,最佳疗效评价为部分缓解(PR)。
02
2022.02.13
Ⅲ级血小板减少,予以升板治疗。
03
2022.06.28
疾病进展(PD)。
04
2022.06.28-2022.08.08
二线予以“帕博利珠单抗+曲妥珠单抗+白蛋白结合型紫杉醇*q3w”治疗,疗效评价为PD。
05
2022.08.08
Ⅲ级血小板减少,予以升板治疗。
06
2022.08.10-2023.06
三线予以“德曲妥珠单抗*q3w”治疗,最佳疗效评价为病情稳定(SD)(缩小)。
07
2022.11.03
Ⅰ级血小板减少,预防性维持治疗。
2、患者CTIT治疗过程
01
2022.02.13
患者一线帕博利珠单抗+曲妥珠单抗+化疗后出现Ⅲ级血小板减少,测血小板计数(PLT)为43×109/L,予重组人血小板生成素(rhTPO)15000U每日一次(qd)治疗10天后,PLT升至306×109/L。
02
2022.08.08
患者二线帕博利珠单抗+曲妥珠单抗+化疗后出现Ⅲ级血小板减少,PLT为34×109/L,予rhTPO15000U qd联合血小板生成素受体激动剂(TPO-RA)海曲泊帕7.5mg qd治疗4天后PLT升至100×109/L,血小板减少显著改善。
03
2022.11.03
患者三线抗体偶联药物(ADC)德曲妥珠单抗治疗后PLT降为100×109/L,院外预防性给予海曲泊帕维持治疗至后续治疗周期开始,保证了抗肿瘤治疗过程中PLT水平的稳定。(图2)

图2 患者CTIT升板治疗过程
HER2是胃癌的重要靶点之一,在胃癌中过表达或基因扩增的比例约为12%-20%[2]。曲妥珠单抗联合治疗奠定了HER2阳性晚期胃癌的一线治疗地位。目前免疫治疗也成为HER2阳性晚期胃癌联合治疗重要的探索方向。KEYNOTE-811研究结果显示对于HER2阳性晚期胃癌患者一线治疗,化疗+曲妥珠单抗+PD-1抑制剂取得高客观缓解率(ORR)和显著优于历史的生存数据[3]。除此之外,新型抗体偶联药物(ADC)的出现也为HER2阳性晚期胃癌患者提供了新的治疗选择。DESTINY-Gastric 01研究证实了在HER2阳性的晚期胃癌患者中应用新型ADC德曲妥珠单抗三线治疗的临床获益[4]。
本例为老年男性患者,晚期胃癌多发转移姑息术后HER2扩增,PD-L1 CPS 8分。根据2023年《美国国立综合癌症网络(NCCN)胃癌临床实践指南》以及《中国临床肿瘤学会(CSCO)胃癌诊疗指南》推荐,予以本例患者PD-1抑制剂帕博利珠单抗+曲妥珠单抗+奥沙利铂+卡培他滨q3w治疗,一线治疗出现疾病进展后二线转换为帕博利珠单抗+曲妥珠单抗+白蛋白结合型紫杉醇q3w治疗,疗效不佳。三线予以德曲妥珠单抗q3w单药治疗后达到SD(缩小)。
本例患者在多线治疗过程中,反复出现Ⅲ级血小板减少,应用rhTPO治疗后血小板减少症改善缓慢,转换rhTPO联合口服TPO-RA海曲泊帕治疗后,患者重度血小板减少得以快速纠正。此外,有研究表明,相较rhTPO单药治疗,海曲泊帕联合rhTPO治疗CTIT可显著提高7天内应答率(75% vs 30%),更快恢复血小板水平,显著缩短中位治疗时间(6.5 vs 9.5天,p<0.0001)[5]。
同时,本例患者已接受多线抗肿瘤治疗,且既往抗肿瘤治疗周期出现Ⅲ级血小板减少,根据《CSCO肿瘤治疗所致血小板减少症诊疗指南》进行CTIT的二级预防。因此,在该患者后续治疗中,予以海曲泊帕进行二级预防,维持了安全稳定的血小板水平,保证了治疗的如期进行。总而言之,对于多线治疗且既往出现过Ⅲ级及以上血小板减少的患者,TPO-RA海曲泊帕能为后线治疗的顺利进行保驾护航。
病例分享者简介
王刚 教授
中国科学技术大学附属第一医院肿瘤内科副主任医师,博士
安徽省医学会肿瘤内科学分会常委
安徽省抗癌协会生物治疗专委会副主委
安徽省抗癌协会肿瘤支持治疗专委会副主委
安徽省全科医学肿瘤学分会常委兼任青委会副主任委员
安徽省抗癌协会胰腺癌专委会委员
安徽省抗癌协会理事
安徽省临床肿瘤学会理事兼秘书
安徽省抗癌协会姑息治疗委员会常委兼秘书
中国抗癌协会老年肿瘤学专委会委员
中国抗癌协会肿瘤异质性个体化治疗专委会委员
专家点评医学界:结合本例患者的抗肿瘤治疗过程,能否介绍一下胃癌不同类型的治疗药物导致CTIT的发生情况?如何评价本例患者的升血小板策略选择?随着肿瘤治疗的不断发展,既往以化疗为核心的抗肿瘤治疗逐渐演变为化疗、靶向、免疫等联合的综合治疗模式。在综合治疗模式下,胃癌患者更易出现骨髓抑制,包括血小板减少。
有研究显示,靶向药物曲妥珠单抗在胃癌的治疗中血小板减少症的发生率可达11%[6];化疗药物紫杉醇所致血小板减少症发生率可高达59.3%,卡培他滨可达27.3%,奥沙利铂可达28.6%[7,8];而ADC所致的血小板减少症发生率可高达52.5%~69.8%,其中≥3级的发生率约为29.8%~45%[9];近年来,以PD-1/PD-L1抑制剂为代表的新型免疫治疗药物已广泛应用于包括胃癌在内的多种晚期恶性肿瘤,其中帕博利珠单抗所致的Ⅲ级及以上血小板减少症发生率约为4%。虽然免疫相关血液学毒性相对少见,但有研究显示其所致CTIT无法纠正时可导致死亡[10],治疗后需密切关注血小板数值。此外,多周期抗肿瘤治疗还会增加骨髓抑制的发生风险和严重程度,需引起重视。
综合上述因素可见,本例患者抗肿瘤治疗过程中具有较高的CTIT发生风险,因此可根据患者具体情况选择合适CTIT防治策略。患者一线接受帕博利珠单抗+曲妥珠单抗+奥沙利铂+卡培他滨q3w治疗后出现Ⅲ级血小板减少,根据《CSCO肿瘤治疗所致血小板减少症诊疗指南(2023版)》(以下简称《CTIT指南》)[11]推荐,首先予以rhTPO治疗后血小板减少症改善缓慢。二线帕博利珠单抗+曲妥珠单抗+白蛋白紫杉醇治疗后q3w再次出现Ⅲ级血小板减少,评估新型TPO-RA药物海曲泊帕联合rhTPO对比rhTPO单药治疗CTIT的有效性和安全性,结合《CTIT指南》推荐予以海曲泊帕联合rhTPO联合治疗,患者血小板快速恢复至正常,升板效果显著。
本例患者三线应用ADC治疗,由于该类药物常出现血液学不良反应,尤其是血小板减少症,根据《抗体药物偶联物治疗恶性肿瘤临床应用专家共识》推荐在治疗期间应定期监测PLT,同时考虑预防性用药进行二级预防。因此,在本例患者三线治疗期间,PLT降为100×109/L,预防性给予海曲泊帕治疗后,患者血小板水平持续稳定,保证了后续抗肿瘤治疗过程能顺利进行。
医学界:能否谈谈本例患者进行CTIT二级预防的依据,以及新一代TPO-RA海曲泊帕在二级预防期间维持给药有何优势?新一代TPO-RA海曲泊帕在CTIT的预防中发挥着重要作用。最新版《CTIT指南》[11]中,海曲泊帕作为目前唯一一个获Ⅱ级推荐(2A类证据)的TPO-RA药物用于CTIT二级预防。该指南推荐主要依据两项研究。其中,一项真实世界研究评估了海曲泊帕预防肿瘤化疗所致的血小板减少症(CIT)的有效性,结果显示海曲泊帕可以有效预防高龄高风险肿瘤患者发生CIT,应答率达100%。
此外,2023年欧洲内科医学大会(ECIM)发布的海曲泊帕在CIT领域Ⅱ期临床研究结果显示[12]:与安慰剂相比,海曲泊帕连续给药可显著提高患者的治疗有效率(60.7% vs. 12.9%,OR=10.4,P=0.0001);在维持治疗期间海曲泊帕连续给药可有效保证下一化疗周期的正常进行,有效率达72%,显著高于安慰剂组29%(图3)。以上数据提示海曲泊帕可更快恢复血小板水平,连续给药进行预防有助于保证后续抗肿瘤治疗正常进行。
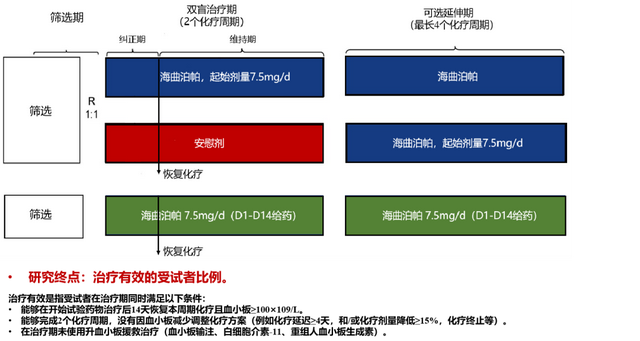
图3 海曲泊帕CITⅡ期临床研究设计
医学界:结合本例CTIT患者升血小板策略,谈谈新一代TPO-RA联合rhTPO的作用机制基础以及联合治疗的优势?就升板机制而言,TPO-RA靶向作用于巨核细胞前体或巨核细胞上TPO受体c-MPL的跨膜域,而rhTPO在胞外结合c-MPL,二者均可刺激下游相同的信号通路转导,诱导巨核细胞增殖和分化以增加血小板的产生。研究表明,海曲泊帕联合rhTPO能明显增强下游STAT3/5、AKT、ERK1/2通路信号强度,显著降低c-MPL受体表达细胞的凋亡率[13]。在治疗CTIT的临床探索中,海曲泊帕联合rhTPO也表现出了显著的疗效和良好的安全性。研究显示,海曲泊帕联合rhTPO治疗可使CTIT患者的PLT快速恢复,中位治疗时间较rhTPO单药组缩短3天,且效果优于rhTPO单药治疗[5]。因此,在《CTIT指南》中海曲泊帕联合rhTPO也获Ⅱ级推荐(2B类证据)。
总之,海曲泊帕联合rhTPO可以发挥协同叠加效应,结合本例患者的诊疗经过,海曲泊帕联合rhTPO在多线治疗且出现血小板减少的晚期肿瘤患者中,可更快更有效地恢复血小板水平,具有广泛的应用前景。
医学界:CTIT的防治是肿瘤全病程管理中至关重要的一环,请谈一谈中国CTIT防治的未来展望以及新一代TPO-RA海曲泊帕在CTIT中的应用前景?近年来,肿瘤诊疗模式发生了很大的变化,接受日间化疗或院外口服抗肿瘤药物成为多数肿瘤患者的治疗选择,而PLT一般在化疗后第五天开始下降,第14天达到最低点,院外CTIT的发生风险和比例明显升高。因此,加强院外管理对CTIT患者至关重要。此外,对于抗肿瘤治疗中既往出现过血小板减少的患者而言,后续治疗周期仍可能再次发生血小板减少,引起治疗中断或增加出血风险,在院外环境中可能会因就医不及时造成严重后果。因此,为避免CTIT带来的不良影响,高风险患者应积极进行二级预防。
海曲泊帕是恒瑞医药自主研发的新一代口服TPO-RA,在CTIT防治过程中,显示出了良好的疗效。同时,相较于rhIL-11和rhTPO以及血小板输注,海曲泊帕治疗血小板减少在便捷性方面具有一定优势,有助于提升患者的用药依从性,能更好地实现CTIT的院外管理。而在CTIT的预防方面,在最新《CTIT指南》[11]推荐中,无论对于CTIT的治疗还是二级预防,海曲泊帕都是目前唯一一个获得Ⅱ级推荐的TPO-RA类药物。
由此可见,海曲泊帕在CTIT的院外管理及二级预防方面展现出巨大的应用潜力,一定程度上满足了目前CTIT的临床治疗需求,未来临床应用前景值得期待。
参考文献:
[1]赫捷,陈万青,李兆申,等. 中国胃癌筛查与早诊早治指南(2022,北京)[J]. 中华肿瘤杂志,2022,44(7):634-666.
[2]Bartley AN, et al. J Clin Oncol. 2017 Feb;35(4):446-464.
[3]Janjigian YY, et al. Nature. 2021 Dec;600(7890):727-730.
[4]Trastuzumab deruxtecan (T-DXd; DS-8201) in pati ents with HER2–positive advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma: Final overall survival (OS) results from a randomized, multicenter, open-label, phase 2 study (DESTINY-Gastric01). 2022 ASCO GI Abstract. 242.
[5]ASH 2022. Poster 3772. Combination of Thrombopoietin Receptor Agonist and Recombinant Human Thrombopoietin for Treating Cancer Therapy Induced Thrombopenia.
[6]Thuss-Patience PC, et al. Lancet Oncol. 2017 May;18(5):640-653.
[7]LEE J L, et al. Br J Cancer, 2008, 99(4):584-590.
[8]Ten Berg MJ, et al. Drug Saf. 2011 Dec 1;34(12):1151-60.
[9]王佳玉, 等. 中国医学前沿杂志(电子版),2021,13(01):1-15.
[10]王理伟.肿瘤,2021,41(12):828-831.
[11]中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)肿瘤治疗所致血小板减少症指南2023[M].北京:人民卫生出版社,2023.
[12]Jun Ma, et al. 2023 European Congress of Internal Medicine, Abstract 2360.
[13]Xie C,et al. J Cell Mol Med. 2018 Nov; 22(11):5367-5377.
调研问题:
* 此文仅用于向医学人士提供科学信息,不代表本平台观点

