2月25日,Biotech科济药业宣布珠海横琴软银欣创股权投资管理企业(有限合伙)旗下基金达成协议,共同投资优恺泽生物医药(上海)有限公司,本次投资结构如下:科济药业将通用型BCMA CAR-T细胞产品、通用型CD19/CD20 CAR-T细胞产品的中国内地权益授予优恺泽,而珠海软银欣创则是投资8000万元人民币进行注册资本认购,本次投资完成后科济药业对优恺泽股权稀释至92%,而珠海软银欣创则是获得优恺泽8%股权。
从投资结构来看,可以视为一次国内版的“Newco”,而珠海软银欣创对科济药业子公司优恺泽高达10亿元,也点燃了二级市场的情绪,科济药业今天暴涨超过21%。

优恺泽本轮融资的投资机构珠海软银欣创“来头不小”,其执行性事务合伙人为深圳凯银合创企业管理有限公司,该公司法人正是软银中国合伙人江敏。
软银中国聚焦于信息技术和医疗健康两大领域,过去投出了多家上市公司,包括迪安诊断、普门科技、理邦仪器和华大基因等等。2023-2024年以来,软银中国出手次数并不多。
软银中国看中了优恺泽哪些价值?这次投资事件的估值是否受到地方落地事务的影响而产生高溢价?
01
优恺泽的两款产品
优恺泽两款产品源于科济药业的通用型CAR-T平台,从披露的靶点上看大概率是CT0590或和CT059X、KJ-C2219,目前这些管线都处于IIT试验阶段。

先提一嘴IIT试验,IIT试验为研究者发起的临床试验,产出数据严格程度通常低IND后的临床(多用于支持新药上市申请的辅助性材料),一般不能替代常规I期临床;不过在一些情况下,IIT试验试验数据可以为IND申请提供支持性数据,可凭此豁免部分I期临床试验,直接进入II期临床试验,科济药业过往有过类似案例。
我们在《双抗后,下一个国产BD风口》提到,通用CAR-T能够突破自体CAR-T疗法的生产成本高、生产时间长等局限性,同时有数据表明可以将CAR-T定制成本从自体疗法的近10万美金降至未来的不到5000美元(单次生产可治疗100名患者),患者可及性极大增强。
不过,通用CAR-T的研发挑战主要集中在移植物抗宿主病(GvHD)、宿主抗移植物反应(HvGR)和疗效持久时间短几个大的问题。
据科济药业披露THANK-uCAR®技术平台,公司不仅采用了传统的敲除TRAC减少GvHD,还通过敲除B2M降低宿主T细胞的排异反应同时减少HvGR,创新性的敲除NKG2A增强通用CAR-T产品的抗肿瘤功能,并且在CAR-T表面装载一个能够识别NK细胞表面NKG2A蛋白的CAR作为反击NK细胞的工具。

从2024 ASH大会披露的IIT数据看,CT0590治疗5位复发/难治性多发性骨髓瘤患者,中位随访时间为16.6个月,其中3例患者获得缓解,包括2例严格完全缓解(sCR)和1例部分缓解(PR)。值得注意的是,2例sCR患者的缓解持续时间(DOR)分别为23个月和20个月,CAR拷贝数峰值大于280000 copies/µg genomic DNA。

IIT小样本数据初步验证了公司THANK-uCAR®技术平台的可行性,具体表现包括患者的安全性良好(无3级及以上CRS、未出现GvHD和没有出现出现DLT等安全性信号)、部分患者体内CAR拷贝数峰值与BCMA CART相当等。
这一早期数据催化可能也是软银中国愿意目前以“溢价”认购仅有中国内地权益优恺泽股份的重要原因,主讲一个通用CAR-T疗法可及性的故事。
科济药业在THANK-uCAR®技术平台的基础上,开发了更强一代的Plus技术平台,以确保不同NKG2A表达水平下平台产品可持续扩增的表现。
一项公司举行的对比数据显示,CT0590在NKG2A低水平表达的情况下,扩增在72小时下降,而Plus平台的CT059X的扩增则是在持续增加。另外,Plus平台下的通用型CD19/CD20 CAR-T在淋巴瘤模型中展现出较一般单靶通用型CAR-T更强的抗肿瘤效果。

02
海外通用CAR-T技术发展
全球范围来看,通用型CAR-T疗法的Biotech不在少数,近来该领域最大的一笔交易波过于罗氏以15亿美元交易总价收购Poseida Therapeutics(目前科济药业的市值正在逼近该交易总价值)。
Poseida这家通用CAR-T公司技术特点非常鲜明,其产品采用的T细胞是来源外周血单个核细胞的干细胞记忆型T细胞(半衰期超长),公司采用的CAR-T基因改造工具平台为Cas-CLOVER基因编辑系统(一种易于操作、高精确度的基因编辑技术),以及自有的Poseida生产制造平台(一次生产高达数百剂、纯度高)等。
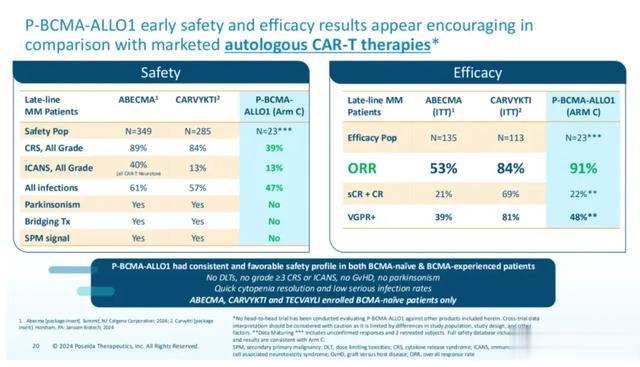
Poseida进度最快的核心管线是靶向BCMA的P-BCMA-ALLO1,已经公布的复发性/难治性多发性骨髓瘤患者的一期临床数据显示,23例患者中治疗组达到高达91%的ORR,而在未接受BCMA靶向治疗的患者中,ORR升至100%;但在接受过至少一次BCMA靶向治疗的患者中,ORR也高达86%。同时,患者的安全性良好,大多数患者CRS、ICANS等副作用只有1级或2级。
在全球通用CAR-T疗法较为知名及进度靠前的Biotech还有Allogene Therapeutics和Wugen。
Allogene的技术路线是部分海外Biotech开发通用CAR-T疗法的一个缩影,坚持采用敲除CD52的路线(克服免疫排斥反应如HvGR、GVHD并增强治疗效果),不过这种路线对患者预处理有很高的要求(使用经典清淋方案基础上接受CAR-T治疗前需要接受CD52抗体治疗将患者体内的CD52阳性细胞,如T细胞和NK细胞耗竭掉)。
Allogene核心产品ALLO-501(Cemca-cel)最新在JCO发表的I期临床数据显示,在33名未经CD19 CAR-T治疗的R/R大B细胞淋巴瘤(LBCL)患者中,取得ORR和CR分别为67%、58%。该研究取得ORR和CR率与已获批的自体CD19 CAR-T细胞在二线后R/R LBCL患者中疗效相当,同时安全性良好(未观察到DLT、GvHD、ICANS和高等级的CRS等安全性信号)。

Wugen公司的通用CAR-T产品WU-CART-007在全球临床进度上名列前茅(临床二期),其技术特点是利用CRISPR/Cas9基因编辑技术敲除CD7和T细胞受体恒定区(TRAC),防止CAR-T细胞自相残杀并达到降低GvHD的风险。
在去年6月公布的治疗复发/难治性(R/R)T细胞急性淋巴细胞白血病/淋巴瘤(T-ALL/LBL)临床二期数据显示,在13名患者(38%接受同种异体干细胞移植患者进展或复发)中,73%患者达成复合完全缓解率(CRc)的主要终点,总ORR高达91%,该数据进一步证实了其拥有优于当前R/R T-ALL/LBL标准疗法的疗效潜力。
以上不难看出,目前全球通用CAR-T疗法处于价值兑现的在早期,随着更多的问题被解决,有望带来新一波BD浪潮。
02
科济药业的价值支撑
通用CAR-T的叙事虽然宏大,但真正的价值验证需要实打实的数据支撑。
当下,错失上一波自体CAR-T出海浪潮的科济药业,主要市值支撑仍在于其CAR-T技术突破实体瘤的管线CT041。

去年年底CT041治疗二线后晚期胃/食管胃结合部腺癌患者的关键II期已取得阳性结果,未来有望在国内实现商业化;据过往CT041的IIT临床数据显示,在51例存在靶病灶的胃癌/食管胃结合部腺癌患者中,ORR和DCR分别为54.9%和96.1%,没有发生DLTs、3级或以上CRS等严重副作用。
对比现有晚期胃癌后线疗法,CT041的mPFS和mOS有很大的优势,但考虑到其未来的主要竞争对手为CLDN18.2 ADC,尽管非头对头数据对比下目前仍有一定优势且国内晚期胃癌存在大量为满足临床需求,但自体CAR-T的可及性预计将低于ADC药物,如果没有碾压性的疗效优势,商业化前景仍然需要验证。

另外,CT041的BD也是投资者关注的一个焦点,数据显示胃癌每年新增患者有超过76%在亚洲地区,这意味着这在欧美不算是一个大适应症,未来BD交易的体量也应顺势放低预期(同时考虑CT041疗效在不同人群的差异性)。

由此,科济药业若想在市值上更近一步,需要CT041的BD授权助力或未来商业化验证,又或者通用CAR-T疗法管线的BD和进一步的数据验证。
结语:回到原点,软银中国对于科济药业子公司优恺泽的下注,一定程度代表了其对公司通用CAR-T技术的认可和未来通用CAR-T商业化可及性的关注,同时给国内甚至全球致力通用CAR-T技术开发的研发者带来更多信心。

—END—
