吸热反应:反应物所具有的总能量低于生成物所具备的总能量,需要摄取能量方能进行。
放热反应:反应物所具有的总能量高于生成物所具备的总能量,将会释放能量。
常见的放热反应涵盖燃烧反应、活泼金属与酸或水的反应以及大多数化合反应(但需留意有些化合反应属于吸热反应)。
常见的吸热反应包含 Ba(OH)₂·8H₂O 与 NH₄Cl 的反应、大多数分解反应以及水解反应。
反应热计算反应热与反应物各物质的物质的量呈正比,其计算公式为 ΔH = E 生成物 - E 反应物 或 ΔH = 反应物的键能总和 - 生成物的键能总和。
盖斯定律:能够凭借已知反应的反应热来推断相关反应的反应热。
热化学方程式之间能够开展数学运算,相应的 ΔH 也进行对应的数学计算。
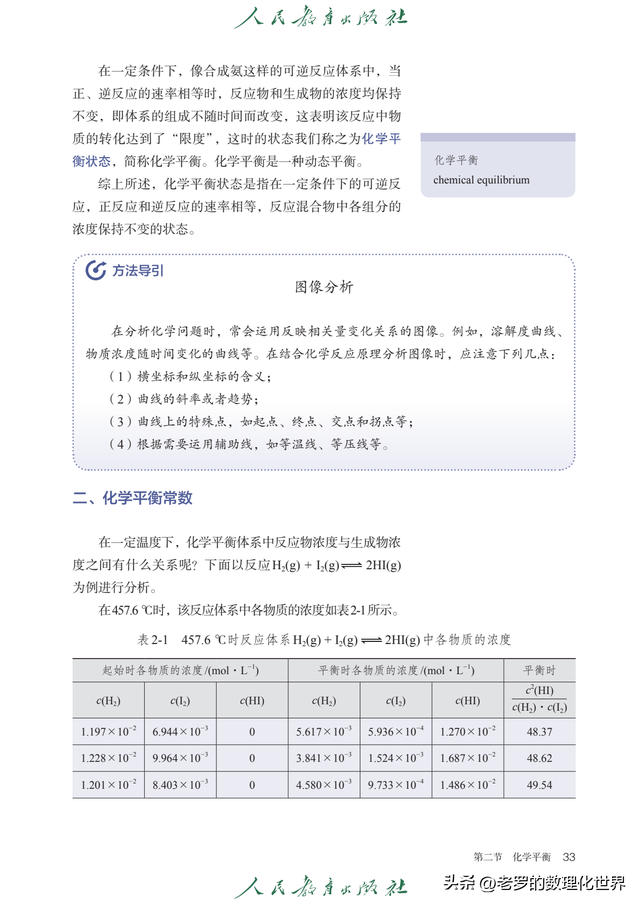
第二章 化学反应速率与化学平衡化学反应速率化学反应速率乃是定量描绘化学反应进行快慢的物理量,通常以单位时间内反应物浓度的降低或生成物浓度的增加予以表示。
其数学表达式为 v = Δc/Δt 或 v = ΔnV/Δt,常用单位为 mol·L⁻¹·s⁻¹ 或 mol·L⁻¹·min⁻¹ 。
化学平衡化学平衡属于一种动态平衡状态,反应物和生成物的浓度维持恒定。
平衡常数 K 的表达式用于阐释平衡状态下各物质的浓度关系,K 值的大小与浓度、压强以及是否使用催化剂均无关联。
影响化学平衡的因素包含温度、压力和浓度等,这些因素的变化会对平衡的位移以及产物的浓度产生影响。
化学反应的方向与调控化学反应的方向由吉布斯自由能变化所决定,当ΔG<0 时,反应自发进行。
可以通过调控反应条件(诸如温度、压力、浓度、催化剂等)来改变反应的速率和平衡状态,以此实现工艺的优化。
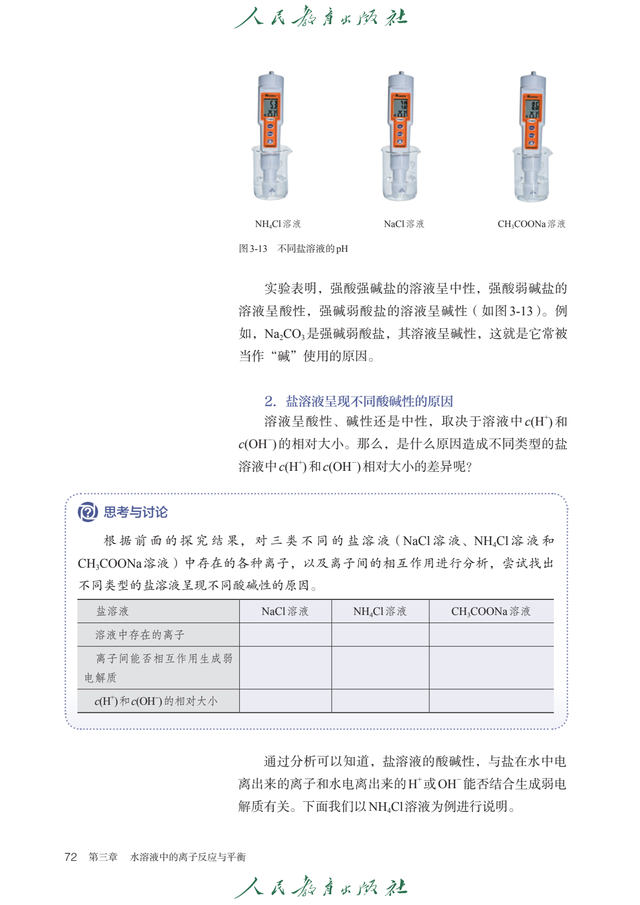
第三章 水溶液中的离子反应与平衡强弱电解质电解质:于水溶液中或熔融状态下能够导电的化合物。
强电解质:在水溶液中或熔融状态下完全电离的电解质,例如强酸、强碱、盐等。
弱电解质:于水溶液中部分电离的电解质,诸如弱酸、弱碱、水等。
电离平衡在特定条件下,当弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等时,电离过程达到电离平衡之态。
电离平衡常数用于描绘电离平衡状态下离子和分子的浓度关系。
影响电离平衡的因素涵盖温度、浓度、同离子效应等。
水的电离与溶液的酸碱性水乃极弱的电解质,能够发生自身电离。
溶液的酸碱性由氢离子浓度和氢氧根离子浓度所决定,pH 值是衡量溶液酸碱性的指标。
中和反应是酸和碱发生反应生成盐和水的过程,能够用来调节溶液的酸碱性。
第四章 化学反应与电能这一章主要探究的是原电池和电解池的工作原理以及它们怎样将化学能转化为电能或将电能转化为化学能。
原电池原电池是一种能够将化学能直接转化为电能的装置。它借助自发进行的氧化还原反应产生电流。
在原电池中,负极发生氧化反应,正极发生还原反应。电子从负极流出,经外电路流向正极,形成电流。
电解池电解池是一种利用电能引发化学反应的装置。它通常用于非自发进行的氧化还原反应。
在电解池中,阳极发生氧化反应,阴极发生还原反应。通过施加电压,电子被迫从阳极流向阴极,从而引发化学反应。
化学反应与电能的应用化学反应与电能的应用极为广泛,包含金属的电化学腐蚀与防护、电镀、电解精炼、燃料电池等领域。
通过理解和掌控化学反应与电能之间的转化过程,能够达成许多重要的工业过程和环境保护举措。
第五章 以下是高清电子书(有需要请收藏)








































































































































综上所述,新人教 A 版高中化学选择性必修一的第一章至第四章囊括了化学反应的热效应、化学反应速率与化学平衡、水溶液中的离子反应与平衡以及化学反应与电能等重要知识点。这些知识点乃是化学学科的基础内容,对于深入理解和应用化学知识具有重要意义。
