
清华大学医学院研究员陈晓媛对话罗氏全球药品开发高级副总裁李昕博士:从药品审评、企业角度看抗肿瘤创新药加速批准政策带来的变化!
3月18日,第四届罗氏肺癌创新论坛成功召开,与会专家在肺癌诊疗前沿进展、抗肿瘤创新药加速审批等多个方面进行了学术交流与思维碰撞。值此盛会之际,“医学界”特邀清华大学医学院研究员陈晓媛对话全球高级副总裁,罗氏全球药品开发中国负责人李昕博士,就抗肿瘤创新药加速审批相关问题分享其真知灼见。
药品审批增设“加快通道”,助力新药上市提速
为鼓励新药研制和创新,2020年版《药品注册管理办法》增设药品加快上市注册程序,明确了“突破性治疗药物”、“附条件批准”、“优先审评审批”、“特别审批”四个“加快通道”[1-2]。
对于这些加快通道,曾在国家药监局药品审评中心(CDE)工作多年的资深审评员陈晓媛研究员给出了细致的介绍:“事实上,监管当局一直都在努力探索加快药品审评审批的路径。具体来讲,早在2005年就对创新药应用了‘特殊审评’程序,希望促进创新产品研发与沟通交流。之后,在审评任务积压严重的时候,设定了‘优先审评审批’路径,希望设定不同的审评序列,加速一些更有价值、更具重要性的产品上市。再后来,从临床价值、临床优势的角度出台了‘附条件批准、突破性治疗’程序,希望把早期临床数据显示明显疗效优势的产品通过加快通道先上市、早日用于患者,再获取更长期的临床获益证据。”
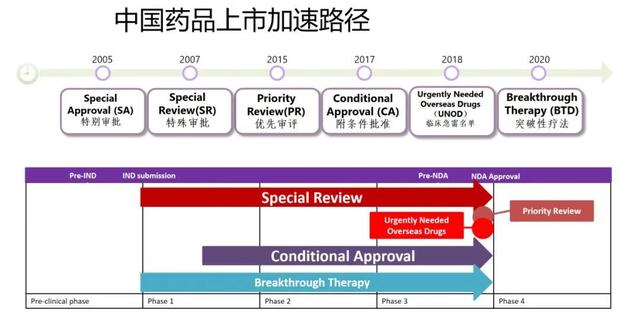
图1. 15年间中国药品上市加速路径
陈晓媛研究员强调,这些加快审批政策的出台,为缩短创新药品的研发周期、审批时间等带来了显著的影响。比如,第一个国产的第三代EGFR-TKI产品,从临床研究到上市,整个研发时间耗时4年,相比于以往8-10年的研发周期,时间明显缩短。就上市审评时限而言,在以前没有加速路径的时候可能需要2年或3年,但纳入优先路径后仅1年甚至更短就获批上市了。
诸多新药在中国落地,见证加速审批之“中国速度”
关于药品审评审批制度改革带来的影响,陈晓媛研究员以肺癌领域为例讲述道:近些年,众多肺癌药物上市,包括小分子靶向药物、抗血管生成药物、免疫治疗药物等,使得肺癌治疗取得了重大的进展。更为重要的是,由于这些产品的研发,特别是小分子靶向药物(如EGFR/ALK/ROS1/MET抑制剂等),让肺癌真正地走上了精准治疗的道路,使其治疗范式、治疗理念得到了彻底改变。
从药企的角度出发,李昕博士分享了她的见解:“1994年,罗氏制药正式落地中国,成为了第一个入驻上海张江的跨国企业。2007年,罗氏全球药品开发中国中心(PD China)正式成立。这15年来,我们亲自目睹了中国药品监管的腾飞,无论是原国家食品药品监督管理总局加入国际人用药品注册技术协调会(ICH),还是国家针对药品审评审批的一系列改革举措。可以说,我们既是参与者,也是获益者。自成立以来,PD China一直都在践行‘为患者加速’的使命,努力把好药、新药尽快地带给中国的患者。在过去的15年里,我们将20个创新产品的54个适应症引入了中国,包括肺癌领域的5个创新产品和12个适应症。其中,在PD China成立后的头十年(2007-2017年),每年平均有1-2个创新药/适应症引入中国。自2015年国家药品审评审批制度改革以来,罗氏在中国获批的新药/适应症数量大幅提升(2018年至2022年每年的获批数量从5个到12个不等)。特别是2018年以来,药物获批进一步提速。
李昕博士举例道:“2018年8月阿来替尼用于ALK阳性晚期非小细胞肺癌(NSCLC)适应症在中国获批,仅比美国晚9个月,比欧盟晚8个月;2022年3月阿替利珠单抗用于NSCLC辅助适应症在中国获批,比美国晚5个月,但比欧盟早近3个月。甚至,近来我们有一款药物已于去年递交中国监管部门并获得优先审批资格,如果今年获批,这将是罗氏的第一款在中国实现全球首发的创新药”。

图2 罗氏肺癌靶向、抗血管生成、免疫药物获批情况
不得不说,中国创新药加速审批的变革,让新药/适应症在中国的获批基本实现了与欧美同步,甚至更早;阿来替尼等创新药的加速获批更见证了“中国速度”!
乘药监改革之东风,发挥跨国药企优势,深耕药品研发和创新
在国家推出创新药加速审批的大环境下,跨国药企是否有其独特优势呢?
“在过去这些年里,国家政策一直鼓励跨国药企把早期研究引入中国,而不是像以前一样,到了Ⅲ期、需更多患者入组时才加入中国患者。同时,针对中国特有的患者人群开展临床试验,比如在中国高发的胃癌、肝癌,甚至于少见的胆管癌,这也是国家鼓励的一个方向。”陈晓媛研究员认为跨国药企在新药研发方面具有一定的优势,“就罗氏来说,其新药研发能力很强,兼有诊断和药品两大领域,在制定研发策略、进行创新设计、探索精准治疗方面均具更多优势。”
针对罗氏,李昕博士补充和归纳了五方面的优势:一是拥有多个独立药品发现的部门从而拥有丰富多元的产品管线;二是就像陈晓媛博士指出的,罗氏兼有制药和诊断,同时还有 基因检测,真实世界数据等平台;三是罗氏在中国拥有研发、生产、营销等环节在内的完整的医药价值产业链;四是罗氏在中国的完整产业链让它拥有中国本土经验、了解中国患者的具体需求;同时作为跨国企业,比如PD China 作为全球药品研发的一部分,拥有全球的经验和专业知识;五是罗氏与中国的渊源要追溯到上个世纪初,它的“先患者之需而行”的理念,它的以科学为导向的制药研发策略,它的多款满足患者未尽之需的创新药,以及对中国的承诺,都树立了罗氏在中国良好的品牌形象。
“目前,罗氏全球约有235个在研项目,其中100个是针对新分子实体药物(NMEs),135个针对已获批药物的新适应症。PD China负责的正在中国进行的临床研究数量超过150项。预计在今后的几年将提交超过50个适应症的上市申请,其中一半以上为肿瘤(包括血液肿瘤)产品。关于肺癌,临床研究已经涵盖了各个阶段,比如新辅助、辅助、一线、二线及后线治疗。”李昕博士进一步阐述了罗氏的产品管线布局。
迎难而上,未来可期
关于中国创新药加速审批未来的改革方向,陈晓媛研究员认为,中国创新药的加速审批路径已日臻成熟,但具体细节的落实仍有待完善。
例如:“就优先审批通道来讲,目前设定的条件似乎有点高,如果不是疫苗、儿童用药、罕见病用药,就必须符合附条件批准的药品、纳入突破性治疗药物程序的药品才有可能获得优先审批,这样就会使企业在操作层面上受限,同时也可能会失去针对不同临床需求设定不同加速路径的初衷。对于条件中的‘其他’具体是指什么?是否可以给出一些可参考的路径,这些细节问题也需要监管部门给予详细指导。”
在中国抗肿瘤创新药加速审批改革的同时,药企也面临着机遇与挑战。李昕博士谈道:“我们经历了中国药监改革的腾飞,它给药企带来了机遇;自药监改革以来,特别是2018年以后,越来越多的罗氏创新产品可以加速引入中国,几乎可与欧美同步获批。当药品监管在很短的时间完成如此大的变革,遇到一些挑战是很正常的。比如怎样鼓励持续创新,合理有效地利用宝贵的临床试验资源。2021年7月CDE提出,要进一步推动以患者为中心、以临床价值为导向的可持续创新,这也是罗氏一贯的追求。我们希望能与监管部门携手合作、共同努力。”
“不管是对企业来讲,还是对患者而言,中国的创新药加速审批政策变化都是非常利好的,使得全球创新药品在中国的同步开发、注册及获批成为可能。未来,希望能更早地将更多更好的创新药带给中国患者。”李昕博士对未来充满了期待。
专家简介 陈晓媛 博士清华大学医学院研究员
陈晓媛 博士清华大学医学院研究员清华大学医学院临床试验中心执行主任,北京清华长庚医院临床试验机构办主任,伦理委员
2002-2019年在国家食品药品监督管理局药品审评中心工作,先后担任了抗感染药物、妇科、放射、血液、抗肿瘤药物的临床审评工作,组织起草了多个抗肿瘤药物临床试验技术指导原则
中国药理学会药物临床试验专业委员会副主委,DIA顾问委员会成员,亦弘商学院研究员
专家简介
李昕 博士
罗氏全球高级副总裁
罗氏全球药品开发中国中心负责人
罗氏全球药品后期开发产品委员会成员
中国外商投资企业协会药品研制和开发工作委员会(RDPAC)研发委员会核心成员
参考文献:
[1]https://gkml.samr.gov.cn/nsjg/fgs/202003/t20200330_313670.html
[2]https://www.nmpa.gov.cn/zhuanti/ypzhcglbf/ypzhcglbfzhcjd/20200416093001445.html
更多肿瘤前沿内容快来“医生站网页版”瞧一瞧👇精彩资讯等你来* 此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场。
